通過氧化反應,可以測定較活潑的金屬氧化物的實驗式。以鎂的氧化物為例,我們可通過金屬鎂與氧的化學反應,獲得氧化物中鎂和氧的質量。實驗步驟大致如下:
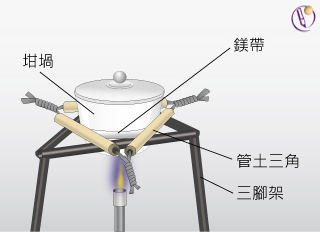
為測定鎂的氧化物的實驗式,某同學將 \(0.923 \text{ g}\) 鎂在空氣中猛烈加熱,令其全部轉化為氧化物。
待氧化物冷卻後,稱得其質量為 \(1.531 \text{ g}\)。通過計算,求出鎂的氧化物的實驗式。
題解:
首先,根據實驗數據,找出各元素的質量。
\(\ce{Mg}\) 的質量 \(= 0.923 \text{ g}\)
\(\ce{O}\) 的質量 \(= 1.531 \text{ g}- 0.923 \text{ g} = 0.608 \text{ g}\)
然後,根據各元素的質量,確定實驗式。
| \(\ce{Mg}\) | \(:\) | \(\ce{O}\) | 1. 確定化合物中的各種元素。 | |
| \(0.923 \text{ g}\) | \(:\) | \(0.608 \text{ g}\) | 2. 找出質量比。 | |
| \(\frac{0.923 \text{ g}}{24.3 \text{ g mol}^{-1}}\) | \(:\) | \(\frac{0.608 \text{ g}}{16.0 \text{ g mol}^{-1}}\) | 3. 將質量比換算為摩爾比。 | |
| \(0.0380 \text{ mol}\) | \(:\) | \(0.0380 \text{ mol}\) | 4. 將摩爾比化簡成最簡整數比。 | |
| \(1\) | \(:\) | \(1\) | ||
| \(\therefore\) 鎂的氧化物的實驗式是 \(\ce{MgO}\)。 | 5. 根據最簡整數比,寫出實驗式。 | |||