一種純物質可能由不同數目的多種原子或離子構成。我們應如何計算 \(1 \text{ mol}\) 純物質中,含有多少摩爾某種原子或離子呢?
如所示,在 \(1\) 個水分子 (\(\ce{H2O}\)) 中,含有 \(2\) 個氫原子和 \(1\) 個氧原子;在 \(1\) 打水分子中,含有 \(2\) 打氫原子和 \(1\) 打氧原子。類似地,在 \(1 \text{ mol}\) 水中,含有 \(2 \text{ mol}\) 氫原子和 \(1 \text{ mol}\) 氧原子。
因此,根據物質的摩爾數和化學式,可以計算出該物質中某種粒子的摩爾數:
\[\text{粒子的摩爾數} = \text{一個化學式單位中該粒子的數目} \times \text{物質的摩爾數}\]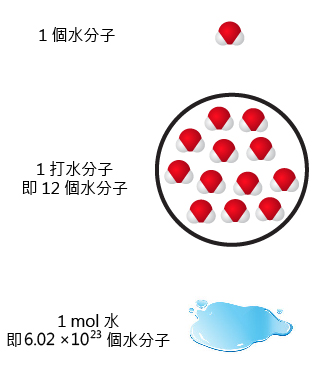
\(0.250 \text{ mol}\) \(\ce{Mg3N2}\) 中含有多少摩爾鎂離子?
題解:
\(\because\) \(1\) 個 \(\ce{Mg3N2}\) 式單位中含有 \(3\) 個 \(\ce{Mg^2+}\),
\(\begin{align} \therefore \; n(\ce{Mg^2+}) & = 3 \times n(\ce{Mg3N2}) \\ & = 3 \times 0.250 \text{ mol} \\ & = 0.750 \text{ mol} \end{align}\)
\(0.125 \text{ mol}\) \(\ce{SO3}\) 中含有多少摩爾原子?
題解:
\(\because\) \(1\) 個 \(\ce{SO3}\) 分子共含有 \(4\) 個原子,
\(\begin{align} \therefore \; n & = 4 \times n(\ce{SO3}) \\ & = 4 \times 0.125 \text{ mol} \\ & = 0.500 \text{ mol} \end{align}\)