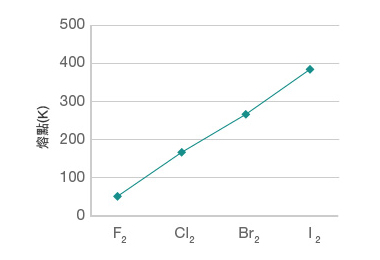
觀察第 \(\text{I}\) 族和第 \(\text{VII}\) 族元素的熔點,我們會發現:
第 \(\text{I}\) 族元素的熔點由上至下逐漸降低。
第 \(\text{VII}\) 族元素的熔點由上至下逐漸升高。
你能否利用元素的鍵合和結構,解釋上述變化?
為甚麼第 \(\ce{I}\) 族元素的熔點由上至下逐漸降低?
第 \(\text{I}\) 族元素均是金屬。金屬熔點的高低,取決於其中金屬鍵的強弱。金屬鍵是金屬陽離子和離域電子之間的靜電吸引力,它的強弱取決於:
若金屬陽離子所帶電荷數目愈多,離域電子數目愈多,即參與鍵合的正負電荷數目愈多,金屬鍵愈強;若金屬陽離子和離域電子之間的距離愈小,金屬鍵愈強。
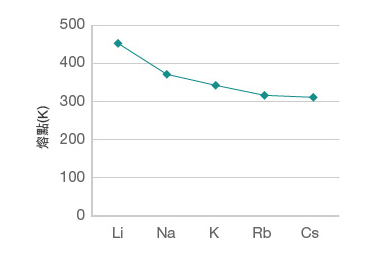
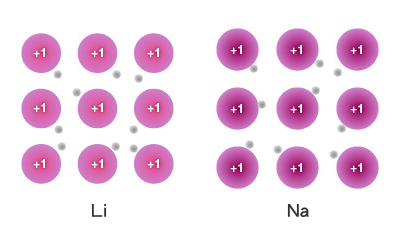
比較第 \(\text{I}\) 族元素的金屬鍵:
金屬陽離子所帶電荷數:第 \(\text{I}\) 族元素的陽離子均帶 \(1\) 個正電荷。
離域電子的數目:每個第 \(\text{I}\) 族元素的原子均提供 1 個離域電子。
金屬陽離子和離域電子之間的距離:由於第 \(\text{I}\) 族元素的原子半徑由上至下逐漸增大,因此,它們的陽離子與離域電子之間的距離由上至下逐漸增大。
隨著第 \(\text{I}\) 族元素的陽離子與離域電子之間的距離逐漸增大,陽離子與離域電子之間的吸引力逐漸減小,即金屬鍵逐漸減弱。因此,第 \(\text{I}\) 族元素的熔點由上至下逐漸降低。
為甚麼第 \(\ce{VII}\) 族元素的熔點由上至下逐漸升高?
第 \(\ce{VII}\) 族元素均是具有簡單分子結構的物質,它們以雙原子分子的形式存在,而且分子之間藉由微弱的范德華力相互連接。
具有簡單分子結構的物質的熔點,取決於其分子間范德華力的大小。而對於組成和結構類似的物質,范德華力的大小主要取決於相對分子質量。若相對分子質量愈大,那麼,分子間的范德華力愈大,物質的熔點愈高。
比較氟 (\(\ce{F2}\))、氯 (\(\ce{Cl2}\)) 、溴 (\(\ce{Br2}\)) 和碘 (\(\ce{I2}\)) 的相對分子質量,很明顯地: \(\ce{F2}\) \(<\) \(\ce{Cl2}\) \(<\) \(\ce{Br2}\) \(<\) \(\ce{I2}\)。由於第 \(\ce{VII}\) 族元素的相對分子質量由上至下逐漸增大,因此,它們的分子間的范德華力由上至下逐漸增大。這導致第 \(\ce{VII}\) 族元素的熔點由上至下逐漸升高。