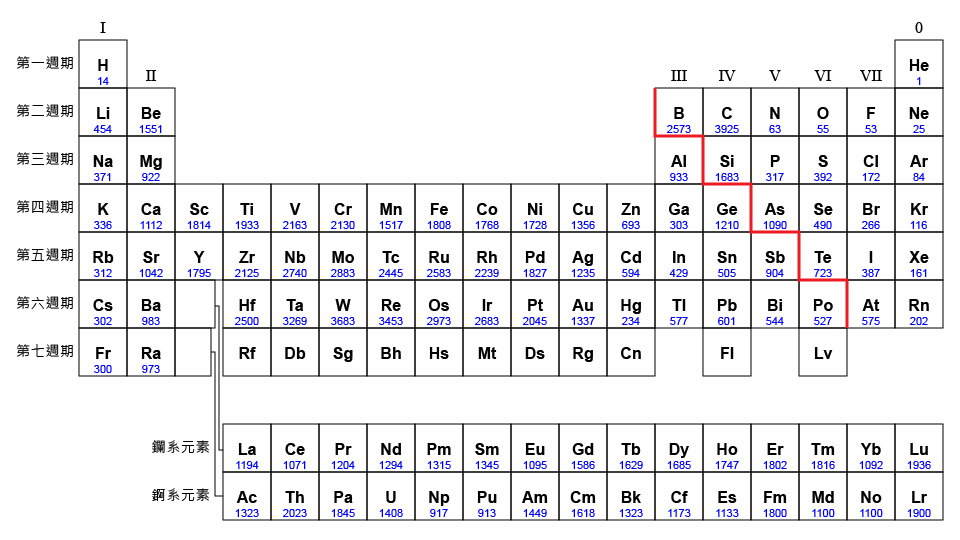
觀察第三週期元素的熔點,我們會發現:
在第三週期內,\(\ce{Na}\)、 \(\ce{Mg}\) 和 \(\ce{Al}\) 的熔點較高,\(\ce{Si}\) 的熔點最高,而 \(\ce{P4}\)、\(\ce{S8}\)、\(\ce{Cl2}\) 和 \(\ce{Ar}\) 的熔點卻較低。
此外,
同為第三週期的金屬,\(\ce{Na}\)、 \(\ce{Mg}\)、\(\ce{Al}\) 的熔點逐漸升高;
同為第三週期的非金屬,\(\ce{S8}\) 的熔點 > \(\ce{P4}\) 的熔點 > \(\ce{Cl2}\) 的熔點 > \(\ce{Ar}\) 的熔點。
你能否利用元素的鍵合和結構,解釋上述變化?
物質的熔點是指該物質從固態熔化為液態過程中,固液共存狀態下的溫度。若要將一種物質熔化,必須提供足夠的熱,以破壞粒子之間的引力。因此粒子之間的引力愈強,物質的熔點愈高。
在第三週期內,\(\ce{Na}\)、 \(\ce{Mg}\) 和 \(\ce{Al}\) 的熔點較高,\(\ce{Si}\) 的熔點最高,而 \(\ce{P4}\)、\(\ce{S8}\)、\(\ce{Cl2}\) 和 \(\ce{Ar}\) 的熔點卻較低。這主要是因為它們的鍵合和結構有顯著的分別。
鈉、鎂和鋁均是金屬,金屬中存在的是金屬鍵。金屬鍵是較強的化學鍵,因此,金屬的熔點較高。
硅具有巨型共價結構,即硅原子之間藉由強共價鍵相互連接成巨型網狀結構。若要破壞原子之間的共價鍵,需要大量的熱,因此硅的熔點非常高。
磷、硫、氯和氬具有簡單分子結構,分子之間通過微弱的范德華力互相連接。若要破壞微弱的范德華力,只需要少許的熱,因此磷、硫、氯和氬的熔點很低。
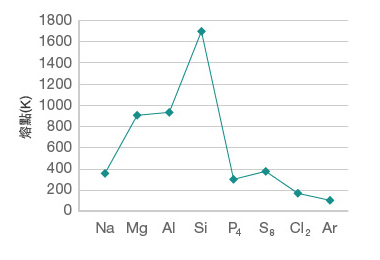
同為第三週期的金屬,為甚麼鈉、鎂和鋁的熔點逐漸升高?
金屬中的化學鍵是金屬鍵。因此,金屬熔點的高低,取決於其中金屬鍵的強弱。金屬鍵是金屬陽離子和離域電子之間的靜電吸引力,它的強弱取決於:
若金屬陽離子所帶電荷數目愈多,離域電子數目愈多,即參與鍵合的正負電荷數目愈多,則金屬鍵愈強;若金屬陽離子和離域電子之間的距離愈小,則金屬鍵愈強。
比較鈉、鎂和鋁三種金屬中的金屬鍵:
金屬陽離子所帶電荷數:\(\ce{Na^+}\) < \(\ce{Mg^2+}\) < \(\ce{Al^3+}\)。
離域電子的數目:每個鈉原子提供 \(1\) 個離域電子,每個鎂原子 \(2\) 個離域電子,而每個鋁原子提供 \(3\) 個離域電子。
金屬陽離子和離域電子之間的距離:由於鈉的原子半徑 \(>\) 鎂的原子半徑 \(>\) 鋁的原子半徑,因此,鈉離子與離域電子之間的距離最大,鎂次之,鋁則最小。
上述因素均會令 \(\ce{Na}\) 的金屬鍵強度 \(<\) \(\ce{Mg}\) 的金屬鍵強度 \(<\) \(\ce{Al}\) 的金屬鍵強度。因此,由 \(\ce{Na}\) 至 \(\ce{Al}\),熔點逐漸升高。
同為第三週期的非金屬,並且均具有簡單分子結構,為甚麼硫 (\(\ce{S8}\)) 的熔點 \(>\) 磷 (\(\ce{P4}\)) 的熔點 \(>\) 氯 (\(\ce{Cl2}\)) 的熔點 \(>\) 氬 (\(\ce{Ar}\)) 的熔點?
具有簡單分子結構的物質的熔點,取決於其分子間范德華力的大小。影響范德華力大小的一個重要因素是相對分子質量。對於組成和結構類似的物質,若它的相對分子質量愈大,則該物質分子間的范德華力愈大,該物質的熔點愈高。
比較磷 (\(\ce{P4}\))、硫 (\(\ce{S8}\))、氯 (\(\ce{Cl2}\)) 和氬 (\(\ce{Ar}\)) 的相對分子質量:
\(\ce{P4}\) 的相對分子質量 \(= 4 \times 31.0 = 124.0\);
\(\ce{S8}\) 的相對分子質量 \(= 8 \times 32.1 = 256.8\);
\(\ce{Cl2}\) 的相對分子質量 \(= 2 \times 35.5 = 71.0\);
\(\ce{Ar}\) 的相對分子質量 \(= 40.0\)。
因為硫的相對分子質量 \(>\) 磷的相對分子質量 \(>\) 氯的相對分子質量 \(>\) 氬的相對分子質量,所以,硫分子間的范德華力 \(>\) 磷分子間的范德華力 \(>\) 氯分子間的范德華力 \(>\) 氬原子間的范德華力。這導致硫的熔點 \(>\) 磷的熔點 \(>\) 氯的熔點 \(>\) 氬的熔點。
