下表顯示的是第三週期元素的導電率 (conductivity)。導電率愈高,物質的導電性愈強。
| 族 | \(\text{I}\) | \(\text{II}\) | \(\text{III}\) | \(\text{IV}\) | \(\text{V}\) | \(\text{VI}\) | \(\text{VII}\) | \(\text{0}\) |
|---|---|---|---|---|---|---|---|---|
| 第三週期元素 | \(\ce{Na}\) | \(\ce{Mg}\) | \(\ce{Al}\) | \(\ce{Si}\) | \(\ce{P4}\) | \(\ce{S8}\) | \(\ce{Cl2}\) | \(\ce{Ar}\) |
| 導電率 (\(\text{S m}^{-1}\)) | \(2.10 \times 10^{8}\) | \(2.38 \times 10^{8}\) | \(3.64 \times 10^{8}\) | \(4.35 \times 10^{-3}\) | \(0\) | \(0\) | \(0\) | \(0\) |
利用元素的鍵合和結構,請你解釋:
為甚麼鈉、鎂和鋁的導電性很高,硅的導電性低,而磷、硫、氯和氬不導電?
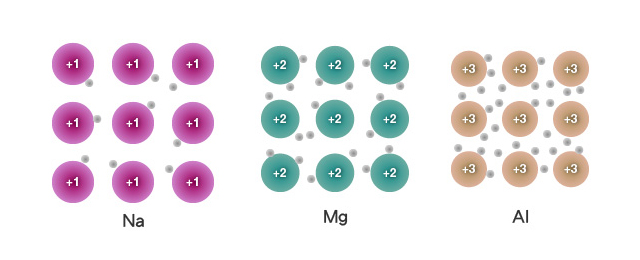
同為第三週期金屬,為甚麼鈉、鎂和鋁的導電性逐漸升高?
橫越第三週期,元素從優良導電體,漸變為半導體,再變為非導電體。
| 族 | \(\text{I}\) | \(\text{II}\) | \(\text{III}\) | \(\text{IV}\) | \(\text{V}\) | \(\text{VI}\) | \(\text{VII}\) | \(\text{0}\) |
|---|---|---|---|---|---|---|---|---|
| 第三週期元素 | \(\ce{Na}\) | \(\ce{Mg}\) | \(\ce{Al}\) | \(\ce{Si}\) | \(\ce{P}\) | \(\ce{S}\) | \(\ce{Cl}\) | \(\ce{Ar}\) |
| 元素的類別 | 金屬 | 類金屬 | 非金屬 | |||||
| 結構 | 巨型金屬結構 | 巨型共價結構 | 簡單分子結構 | |||||
| 鍵合 | 優良的導電體 | 半導體 | 非導電體 | |||||
元素是否導電,取決於該元素的結構中是否存在能自由移動的電子。
鈉、鎂和鋁都是金屬,具有巨型金屬結構。在巨型金屬結構中,存在能自由移動的離域電子。因此,它們都是優良的導電體。然而,每個鈉原子提供一個離域電子,每個鎂原子提供兩個離域電子,而每個鋁原子提供三個離域電子。隨著離域電子數目的增加,從鈉、鎂至鋁的導電性逐漸增強。
在硅的結構中,每個硅原子與另外四個硅原子通過共價鍵相互連接,而形成巨型共價結構。硅的結構內幾乎沒有能自由移動的電子,因而在室溫下,硅難以導電。但是,在高溫下 (或含有少許雜質時),電子能夠獲得足夠的能量而變成能自由移動的離域電子,令硅可以導電。因此,硅是一種半導體材料。
磷、硫、氯和氬都是具有簡單分子結構的物質。在簡單分子結構中,不存在能自由移動的電子,因此,它們全都不能導電。