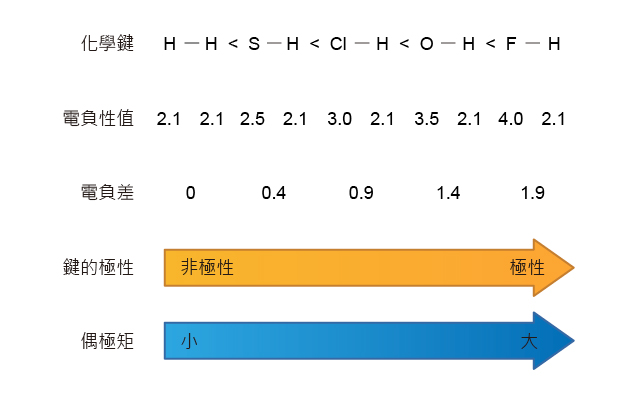
鍵的極性主要取決於共價鍵中兩個原子的電負性值的差距。
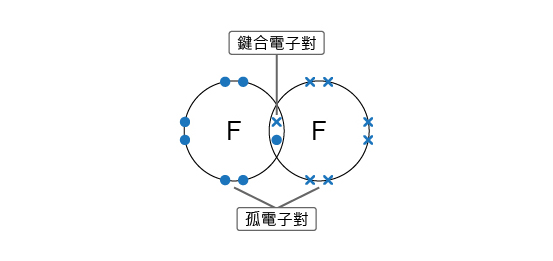
如果兩個原子擁有相同的電負性,它們生成的共價鍵是非極性的。這是因為鍵合電子被兩個原子平均地共用。例如:氫分子 (\(\ce{H-H}\)) 和氯分子 (\(\ce{Cl-Cl}\))。
但要留意,只要兩個原子擁有相同的電負性,不論是單鍵、雙鍵還是三鍵,這些共價鍵是非極性的。例如:氧分子 (\(\ce{O=O}\))。
要是兩個原子擁有不同的電負性,它們生成的共價鍵是極性的。這是因為鍵合電子被兩個原子不平均地共用。例如:氟化氫 (\(\ce{H-F}\)) 和水 (\(\ce{H-O-H}\))。
兩個原子的電負性相差越小,這個共價鍵的極性則越小,最極端的情況是兩個原子擁有相同的電負性,這個共價鍵是非極性的。兩個原子的電負性相差越大,這個共價鍵的極性則越大。
這個情況就好像是 \(2\) 個人在拔河,原子核就比喻為拔河參與者,電子就比喻為繩中間的標記,而原子的電負性就比喻為參與者的力氣。

非極性共價鍵就是不帶極性的共價鍵。
在一個共價鍵中,當共價鍵中的兩個原子擁有相同的電負性值,鍵合電子對便會平均地被兩個原子共用。
鍵合電子被同等力度的拉力拉扯,所形成的共鍵價是非極性的。這情況與兩組力量相同的參賽者在拔河一樣。

例如:在氫分子 (\(\ce{H-H}\)) 中,氫的電負性值是 \(2.1\)。由於兩個氫的電負性值相同,因此鍵合電子對便會平均地被兩個原子共用。
當兩個原子平均地共用鍵合電子時,所生成的共價鍵是不帶極性的。
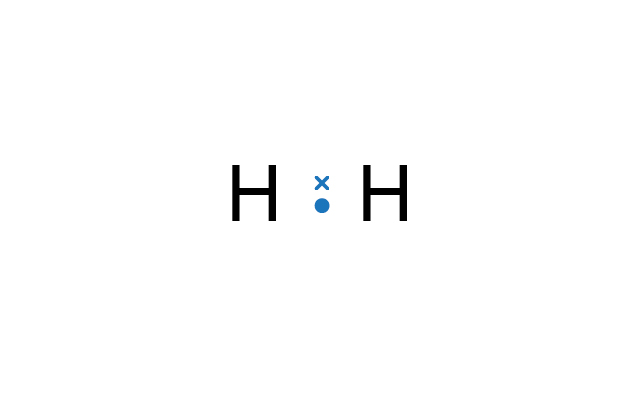
極性共價鍵就是不帶極性的共價鍵。
當共價鍵中的兩個原子擁有不同的電負性值,鍵合電子對便不會平均地被兩個原子共用。電負性較高的原子比電負性較低的原子佔有較多鍵合電子,亦即鍵合電子對被拉向電負性較高的原子。
共用電子被拉向電負性較高的原子,結果該原子具有部分負電荷,而電負性較低的原子則具有部分正電荷,所形成的共價鍵是極性的。這情況與兩組力量不同的參賽者在拔河一樣。

例如:在氟化氫 (\(\ce{H-F}\)) 中,氟的電負性值是 \(4.0\),氫的電負性值是 \(2.1\)。由於氟的電負性值較高,因此鍵合電子對移得較近氟。
當兩個原子不平均地共用鍵合電子時,所生成的共價鍵是帶極性的。
電負性較低的原子帶部分正電荷,我們可用 \(δ+\) 表示;電負性較高的原子帶部分負電荷,我們可用 \(δ-\) 表示。
而這個極性共價鍵的偶極矩,我們可用箭頭表示:箭頭由電負性較低的原子指向電負性較高的原子,並在電負性較低的一方用「+」表示。
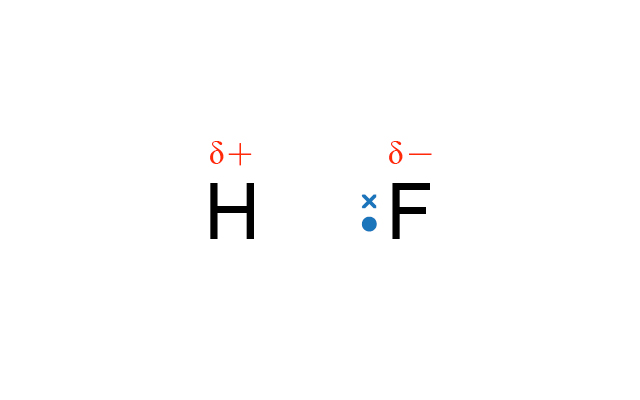
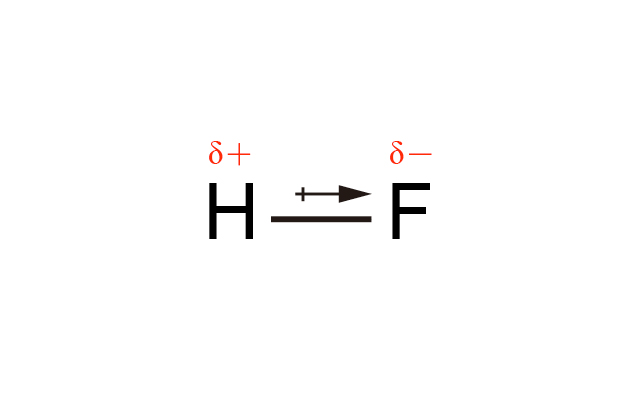
所有極性的共價鍵都有偶極矩,它是一個向量,用來表示共價鍵極性的程度。
當一個共價鍵的偶極矩越大,這個共價鍵便越極性;當一個共價鍵的偶極矩越小,這個共價鍵的極性便越小,最極端的情況便是非極性。
例如:氟化氫中的共價鍵是由氟和氫構成,氟原子的電負性是 \(4.0\),氫原子的電負性是 \(2.1\),因此它們的電負性差距是 \(1.9\),\(\ce{H-F}\) 的共價鍵是極性共價鍵。