電負性是原子的性質,它是指原子在一個共價鍵中對鍵合電子的吸引能力。電負性較高的原子較能吸引鍵合電子對,令電子更接近該原子。
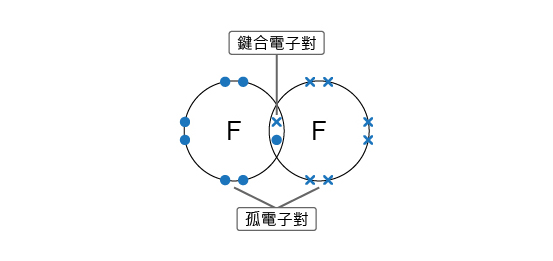
這個情況就好像是 \(2\) 個人在拔河,原子核就比喻為拔河參與者,電子就比喻為繩中間的標記,而原子的電負性就比喻為參與者的力氣。

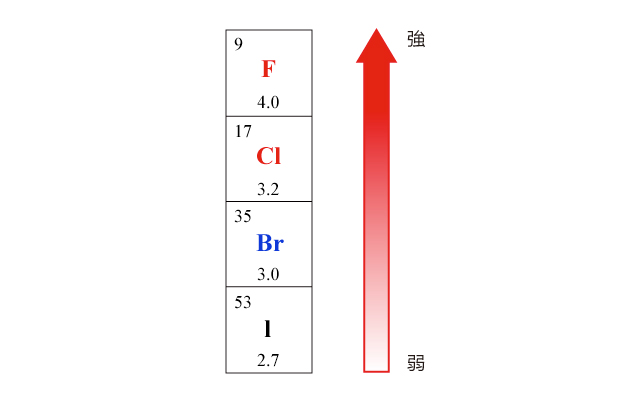
在同一族中,元素的電負性遞減。例如鹵素的電負性:
\(\ce{F > Cl > Br > I}\)
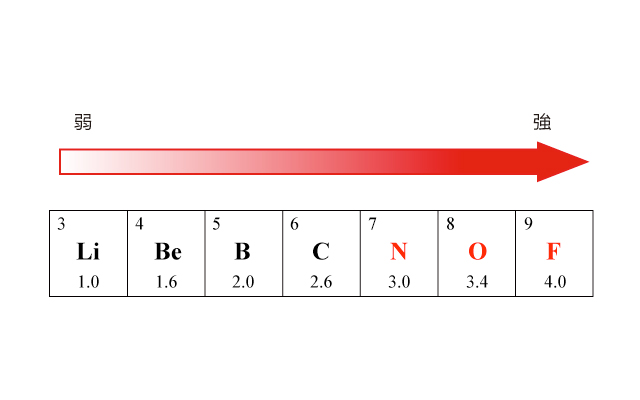
在同一週期中,元素的電負性遞增。例如第二週期中元素的電負性:
\(\ce{Li < Be < B < C < N < O < F}\)
貴氣體擁有穩定的電子排佈,在大部分情況下,貴氣體不會生成共價鍵,在此不考慮貴氣體的電負性。
共價鍵中兩個原子的電負性差距能影響共價鍵的特性,甚至影響共價分子的特性。