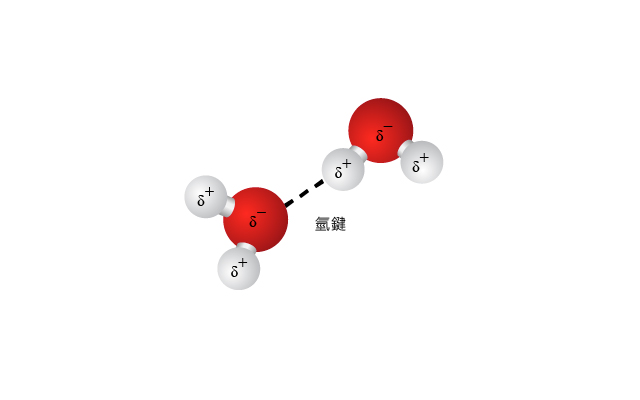
\(2\) 個電負性不同的原子組成共價鍵,這個共價鍵就是極性共價鍵。\(2\) 個原子的電負性差距越大,極性共價鍵的偶極矩便越大。極性分子與極性分子之間的分子間引力就構成偶極間引力。
當極性分子符合指定條件時,它們之間的分子間引力就是氫鍵:
分子中的氫原子必須與一個電負性很高的原子鍵合(例如 \(\ce{F}\)、\(\ce{O}\) 或 \(\ce{N}\));
另一個分子必須含有一個負電性很高的原子提供孤電子對(例如氟、氧或氮)。
簡單的例子包括 \(\ce{HF}\)、\(\ce{H2O}\) 和 \(\ce{NH3}\),而 \(\ce{CH3CH2OH}\) 亦符合以上兩個條件。
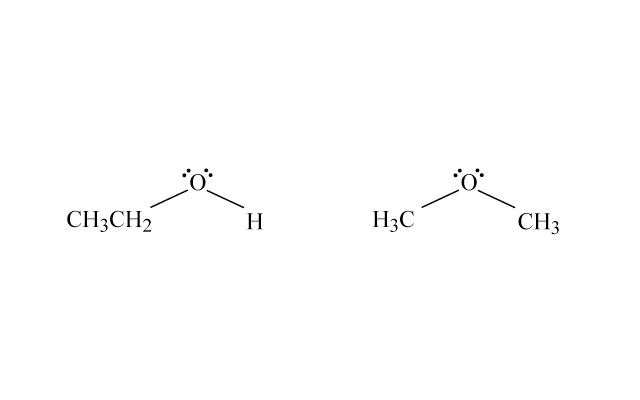
甲氧基甲烷(\(\ce{CH3OCH3}\))、乙醇(\(\ce{CH3CH2OH}\))、丙烷(\(\ce{CH3CH2CH3}\))和乙醛(\(\ce{CH3CHO}\))的相對分子量都是相約,但沸點卻有很大的差異。
乙醇和甲氧基甲烷都是同分異構,但由於原子排列的方式不同,導致乙醇分子之間能產生氫鍵,而甲氧基甲烷之間只有偶極間引力,因此乙醇的分子間引力較高,並擁有較高沸點。
丙烷是非極性分子,分子之間只有范德華力;乙醛是極性分子,分子之間由偶極間引力連繫,因此乙醛的分子間引力較高,並擁有較高沸點。
| 化合物 | 沸點 (\(\ce{^{\circ} C}\)) | 相對分子量 (\(\ce{g/mol}\)) | 分子間引力 |
|---|---|---|---|
| \(\ce{CH3OCH3}\) | \(−24.8\) | \(46.1\) | 偶極間引力 |
| \(\ce{CH3CH2OH}\) | \(78.4\) | \(46.1\) | 氫鍵 |
| \(\ce{CH3CH2CH3}\) | \(−42.0\) | \(44.1\) | 范德華力 |
| \(\ce{CH3CHO}\) | \(20.2\) | \(44.1\) | 偶極間引力 |
我們就以簡單的分子:\(\ce{HF}\)、\(\ce{H2O}\) 和 \(\ce{NH3}\) 為例,說明氫鍵是如何形成
氫鍵對物質的性質的影響非常顯著,例如乙醇和水。
| 化合物 | 沸點 (\(\ce{^{\circ} C}\)) | 相對分子量 (g/mol) | 分子間引力 |
|---|---|---|---|
| \(\ce{CH3OCH3}\) | \(−24.8\) | \(46.1\) | 偶極間引力 |
| \(\ce{CH3CH2OH}\) | \(78.4\) | \(46.1\) | 氫鍵 |
| \(\ce{H2O}\) | \(100.0\) | \(18.0\) | 氫鍵 |
甲氧基甲烷(\(\ce{CH3OCH3}\))和乙醇(\(\ce{CH3CH2OH}\))是同分異構,但乙醇的結構使它能產生氫鍵,而甲氧基甲烷之間只有偶極間引力,因此乙醇的沸點比甲氧基甲烷的高。
而乙醇與水分子之間能產生氫鍵,因此乙醇能溶於水中;而甲氧基甲烷不能與水產生氫鍵,所以它不溶於水。
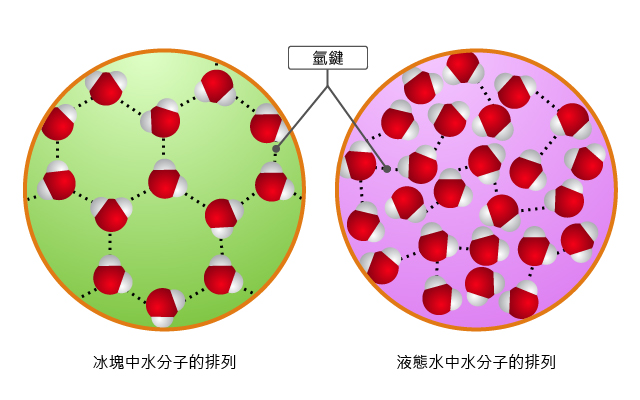
水分子之間的氫鍵使它擁有特物的性質。
例如:雖然水的相對分子量比乙醇和甲氧基甲烷低很多,但它的沸點卻是最高的。這是因為水分子之間能產氫鍵,每一個水分子都能與周圍的水分子(四至五個,水的氫鍵不斷斷裂和重建)產生氫鍵,因此需要更多的熱能才能把水氣化,這使水擁有較高的沸點。
另外,水的密度高於冰,因此冰是浮於水面,而不是沉於水底。因為在固態情況下(即是冰),水分子與水分子之間的震動和轉動都受到較大的限制,每個水分子都只可與四個水分子產生氫鍵;而在液態情況下(即是水),水分子與水分子之間的震動和轉動比較自由和激烈,每個水分子可與四至五個水分子產生氫鍵(即多於四個,但少於五個),更多的氫鍵使水分子互相靠近,所以液態水的密度比冰高。