分子的極性取決於分子中共價鍵的偶極矩。
如果分子中只有一個共價鍵,那麼這個分子是否極性就完全取決於這個共價鍵的極性。
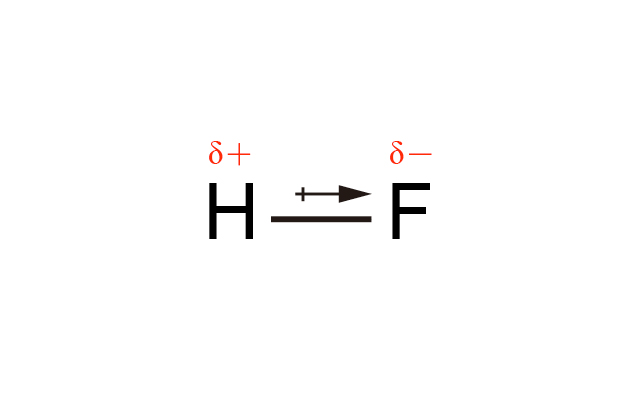
共價鍵越極性,分子便越極性。例如:\(\ce{HF}\) 比 \(\ce{HCl}\) 極性。
如果分子中擁有多於一個共價鍵,那麼分子的極性取決於它的合偶極矩,即是所有共價鍵的偶極矩的向量總和。合偶極矩越大,分子的極性越高。
而這亦即是說,擁有極性共價鍵的分子,亦不一定是極性分子;只擁有非極性共價鍵的分子,就是非極性分子。
以下是一些擁有極性共價鍵的非極性分子,這是因為它的合偶極矩為 \(0\)。
這是因為分子中的極性共價鍵對稱地排列,因此它的偶極矩互相抵消。
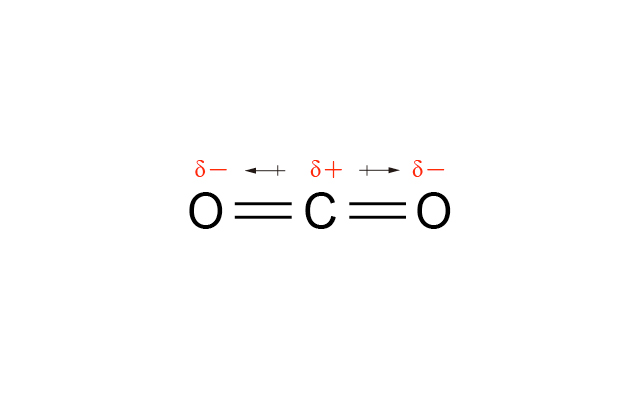
\(\ce{CO2}\) 中 \(\ce{O}\) 的電負性比 \(\ce{C}\) 高,因此 \(\ce{C=O}\) 是極性共價鍵,但由於 \(\ce{CO2}\) 是線形,\(2\) 個 \(\ce{C=O}\) 鍵的偶極矩互相抵消,所以 \(\ce{CO2}\) 是非極性分子。
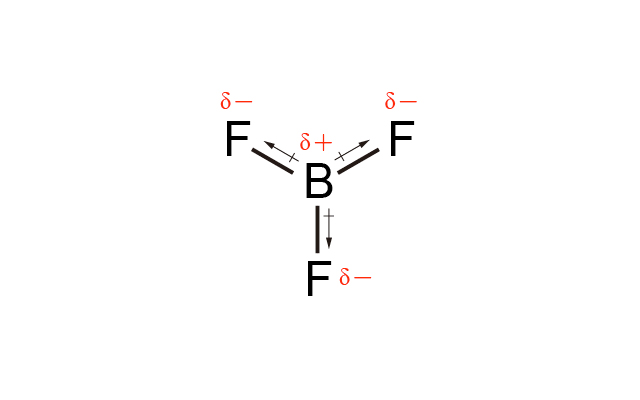
\(\ce{BF3}\) 中 \(\ce{F}\) 的電負性比 \(\ce{B}\) 高,因此 \(\ce{B-F}\) 是極性共價鍵,但由於 \(\ce{BF3}\) 是平面三角形,\(3\) 個 \(\ce{B-F}\) 鍵的偶極矩互相抵消,所以 \(\ce{BF3}\) 是非極性分子。

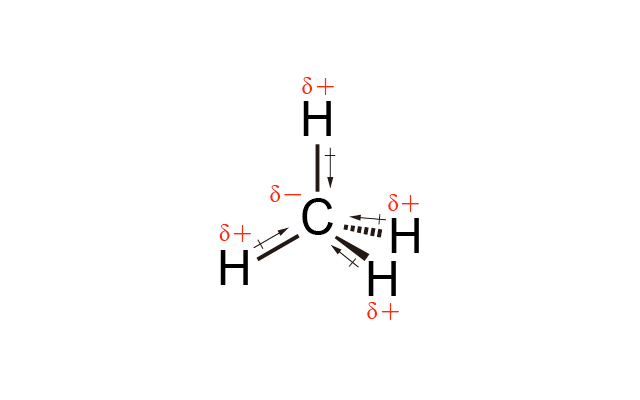
\(\ce{CH4}\) 中 \(\ce{C}\) 的電負性比 \(\ce{H}\) 高,因此 \(\ce{C-H}\) 是極性共價鍵,但由於 \(\ce{CH4}\) 是四面體形,\(4\) 個 \(\ce{C-H}\) 鍵的偶極矩互相抵消,所以 \(\ce{CH4}\) 是非極性分子。
以下是一些擁有極性共價鍵的極性分子,這是因為它的合偶極矩大於 \(0\)。
\(\ce{HF}\) 中 \(\ce{F}\) 的電負性比 \(\ce{H}\) 高,\(\ce{H-F}\) 是極性共價鍵,\(\ce{HF}\) 是線形,因此 \(\ce{HF}\) 是極性分子。

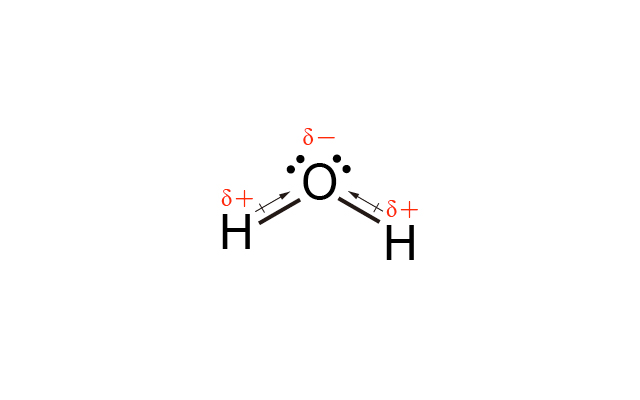
\(\ce{H2O}\) 中 \(\ce{O}\) 的電負性比 \(\ce{H}\) 高,\(\ce{O-H}\) 是極性共價鍵,\(\ce{H2O}\) 是 \(\ce{V}\) 形,因此 \(\ce{H2O}\) 是極性分子。
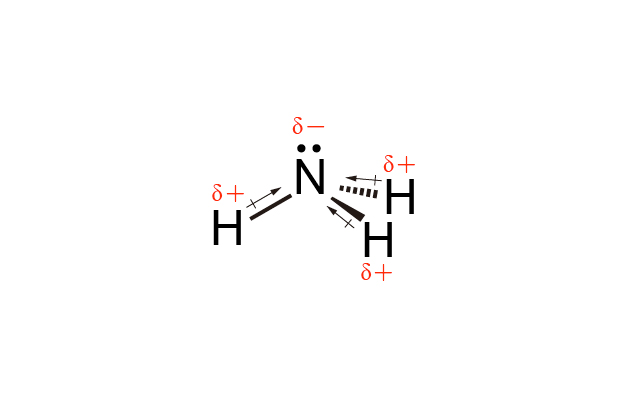
\(\ce{NH3}\) 中 \(\ce{N}\) 的電負性比 \(\ce{H}\) 高,因此 \(\ce{N-H}\) 是極性共價鍵,\(\ce{NH3}\) 是三角錐體形,因此 \(\ce{NH3}\) 是極性分子。
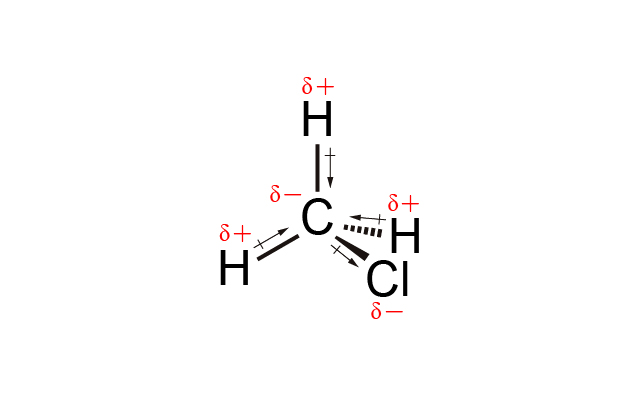
\(\ce{CHCl3}\) 中 \(\ce{Cl}\) 的電負性比 \(\ce{C}\) 高,\(\ce{C}\) 的電負性比 \(\ce{H}\) 高,因此 \(\ce{C-Cl}\) 和 \(\ce{C-H}\) 是極性共價鍵,\(\ce{CHCl3}\) 是四面體形,因此它的合偶極矩是大於 \(0\),是極性分子。