碰撞理論是一個常用來解釋化學反應速率的理論。根據這個理論,化學反應的發生是因為反應物粒子互相碰撞。
透過以下的動畫,了解碰撞理論。
固體反應物的表面面積是其中一個影響化學反應速率的因素。
在一個化學反應中,即使是相同質量的固體反應物,只要增加或減少它的表面面積,那麼這個反應的反應速率便會相應地加快或減慢。
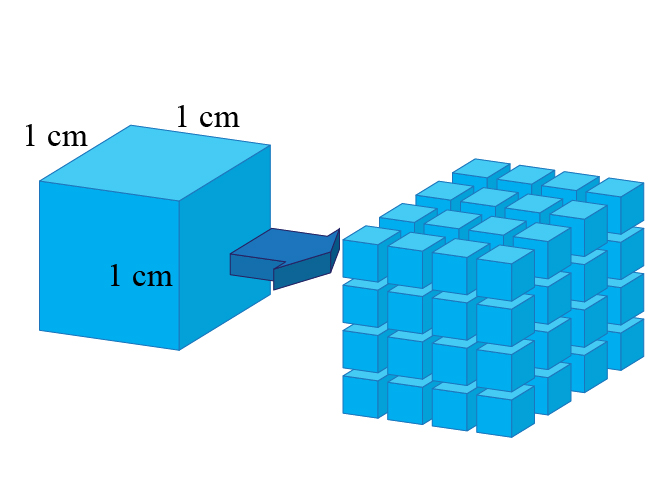
試想想, \(1\;\rm{cm}^{3}\) 的立方體,當它被分割成 \(27\) 個大小相同的立方體時,它的表面面積增加了多少倍。
| 立方體數目 | 立方體邊長 (\(\rm{cm}\)) | 總表面面積 (\(\rm{cm}^{2}\)) | |
|---|---|---|---|
| 分割前 | \(1\) | \(1\) | \(6\) |
| 分割前 | \(27\) | \(0.33\) | \(18\) |
對於相同質量的固體反應物,固體反應物被分割得越小,它的表面面積就會越大,這增加了反應物之間的接觸機會。
我們可透過以下反應,探討固體反應物的表面面積與反應速率的關係:
\[\text{CaC}{{\text{O}}_{\text{3}}}\text{(s) + 2HCl(aq)}\to \text{CaC}{{\text{l}}_{\text{2}}}\text{(aq) + }{{\text{H}}_{\text{2}}}\text{O(l) + C}{{\text{O}}_{\text{2}}}\text{(g)}\]
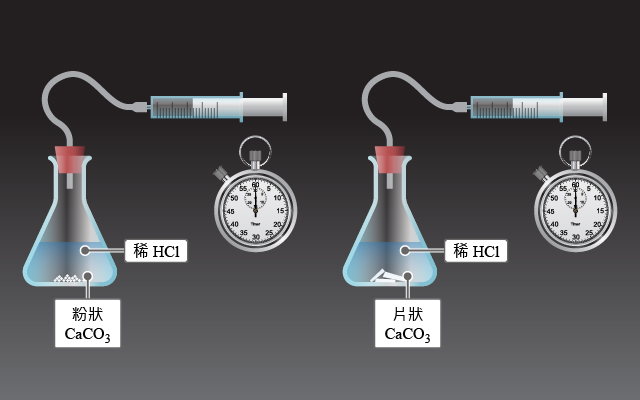
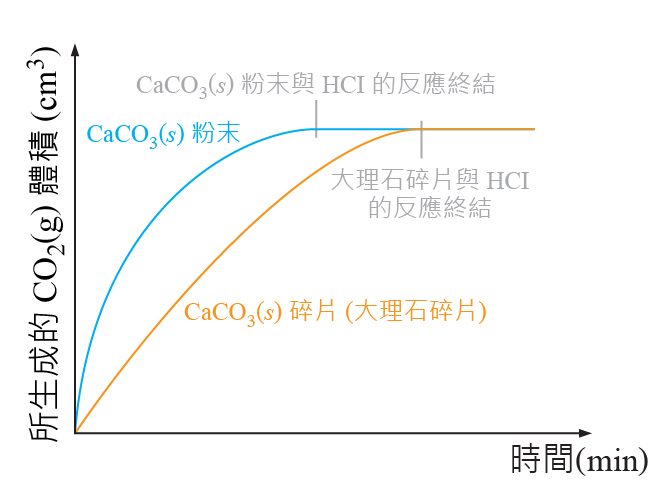
我們分別進行 \(2\) 組實驗:使用質量相同的碳酸鈣固體(一組是碎片,另一組則是粉末),在恆溫的狀態下,分別與過量的稀氫氯酸 (\(1.0\;\rm{M}\))反應。
粉末狀的碳酸鈣的反應速率比碎片狀的碳酸鈣的反應速率快。
這是因為碳酸鈣粉末的總表面積大於碳酸鈣碎片的總表面面積,當總表面面積的增加,反應物粒子之間的接觸機會增加,從而增加粒子的有效碰撞數目,最後反應速率提升。