碰撞理論是一個常用來解釋化學反應速率的理論。根據這個理論,化學反應的發生是因為反應物粒子互相碰撞。
透過以下的動畫,了解碰撞理論。
反應速率會隨著溫度變化而改變:反應溫度越低,反應速率越低;反應溫度越高,反應速率則越高。
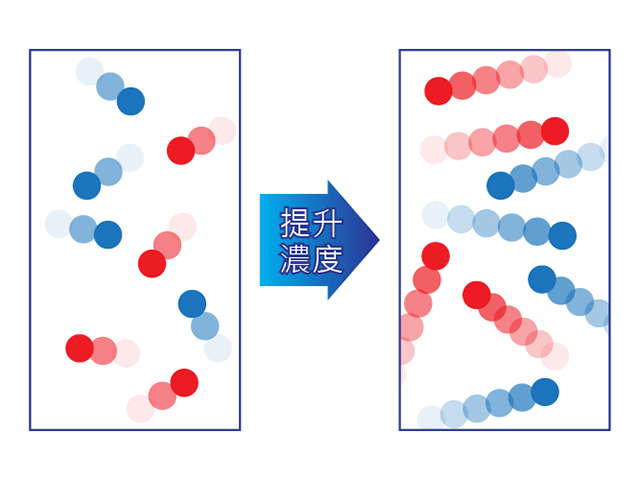
反應溫度越高,碰撞頻率則越高,導致有效碰撞的頻率越高,從而提升反應速率。
我們可藉著硫化硫酸鈉與氫氯酸的反應,探討反應溫度對反應速率的影響。
\[\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}}\text{(aq) + 2HCl(aq)}\to \text{2NaCl(aq) + S}{{\text{O}}_{\text{2}}}\text{(g) + }{{\text{H}}_{\text{2}}}\text{O(l) + S(s)}\]
我們先準備 \(2\) 個相同濃度和相同分量的反應物組合,但它們分別在不同溫度下進行反應(\(25\;^{\circ}\rm{C}\) 和 \(60\;^{\circ}\rm{C}\))。
另外,在反應瓶的底部分別放置一張畫有「十」字的白卡紙,由於這個化學反應會產生沉澱物硫,因此白卡紙上的「十」字在漸漸被遮蓋。我們分別記錄兩組實驗裝置要花多少時間完全遮蓋「十」字。
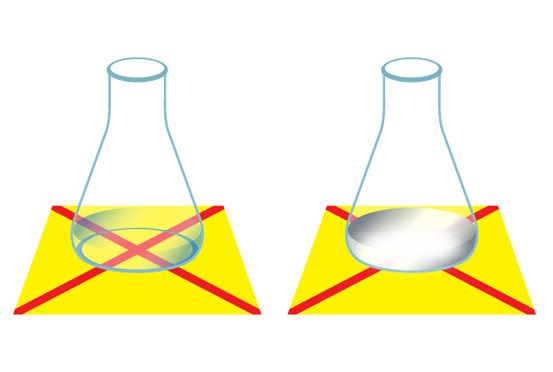
我們發現,當反應溫度越高,「十」字在較短的時間內被完全遮蓋;反應溫度越低,則需要較長的時間才可把「十」字完全遮蓋。
換句話說,反應溫度越高,「十」字消失得越快。
而十字消失得越快,即表示反應的平均速率越高。
\[\text{反應的平均速率}\propto \frac{\text{1}}{\text{「十」字消失所需的時間}}\;\;\]