碰撞理論是一個常用來解釋化學反應速率的理論。根據這個理論,化學反應的發生是因為反應物粒子互相碰撞。
透過以下的動畫,了解碰撞理論。
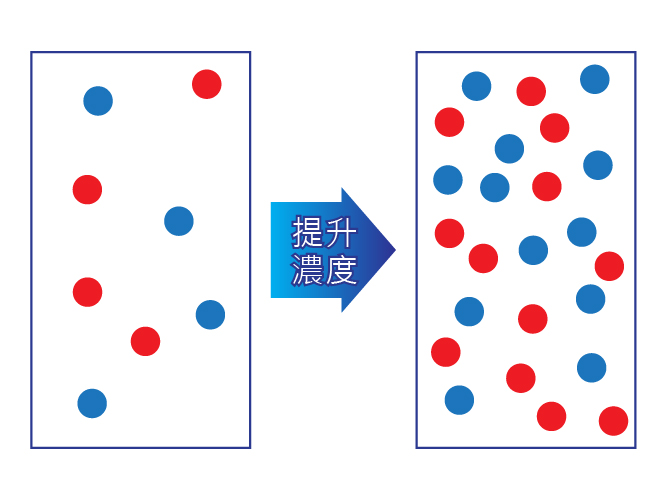
當反應物的濃度越高,反應速率亦會增加。這可用反應物粒子之間的有效碰撞數目來解釋。當反應物的濃度增加時,反應物粒子間變得較擠擁和接近,從而增加有效碰撞的數目和反應速率。
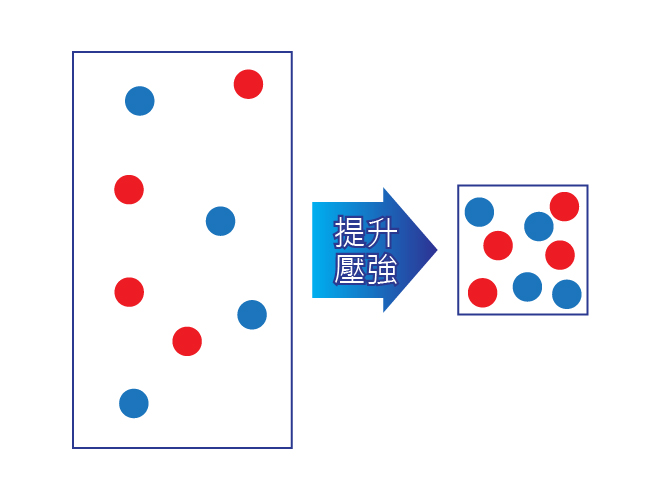
對於涉及氣態反應物的化學反應來說,反應混合物的壓強越大,即是反應物粒子之間的距離越短,這使反應物粒子的碰撞頻率越高,從而提升反應速率。
在特定的溫度下,較高的壓強即表示每個單位體積所含的反應物粒子數目較多,換句話說,就是反應物粒子的濃度較高。
因此,對於氣態反應物來說,壓強越大,濃度越高。
由於固體和液體的體積都是不可壓縮,因此壓強對它們的反應速率影響不大。
從鎂 (\(\rm{Mg}\)) 與稀氫氯酸 (\(\rm{HCl}\)) 的反應,可顯原反應物的濃度對反應速率的影響。
\[\text{Mg(s) + 2HCl(aq)}\to \text{MgC}{{\text{l}}_{\text{2}}}\text{(aq) + }{{\text{H}}_{\text{2}}}\text{(g)}\]
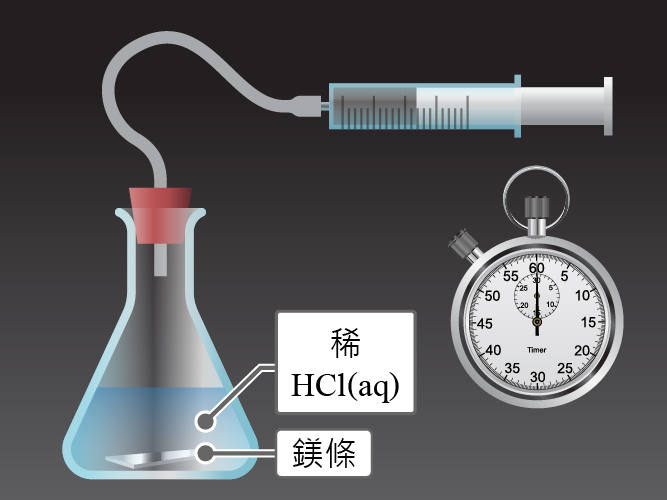
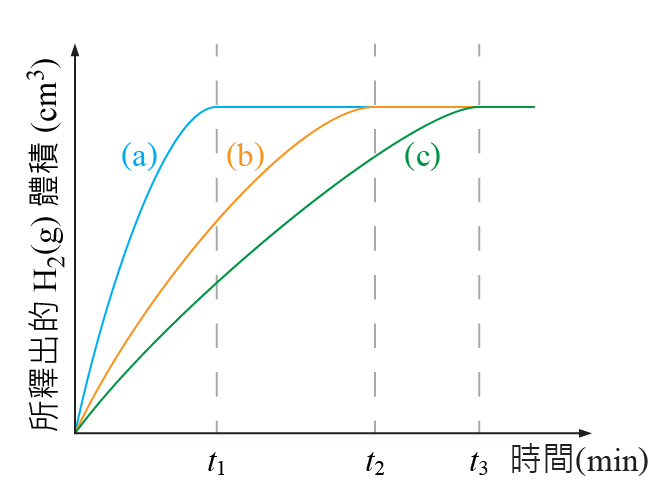
把 \(3\) 份相同質量的粉狀 \(\rm{Mg}\) 分別放進濃度為 \(2.0\;\rm{M}\)、\(1.0\;\rm{M}\) 和 \(0.5\;\rm{M}\) 的過量氫氯酸 (\(\rm{HCl}\)) 中。然後記錄這 \(3\) 組不同裝置在不同時間所釋放出來的氫氣體積。
從圖中可見,濃度較高的氫氯酸與鎂完全反應所需的時間比較短,濃度較低的氫氯酸與鎂完全反應所需的時間比較長。
濃度較高的曲線在任何特定時間的斜率比濃度較低的曲線大。
簡單而言,反應物的濃度越高,反應的速率越高。
當反應物的濃度越高,反應速率亦會增加。這可用反應物粒子之間的有效碰撞數目來解釋。當反應物的濃度增加時,反應物粒子間變得較擠擁和接近,從而增加有效碰撞的數目和反應速率。