有沒有留意到某些化學反應十分激烈,只消數分鐘就會完成,例如鈉與水的反應;另一些則十分緩慢,需要數月才會看見轉變,例如鐵的鏽蝕。
我們可回想日常生活中的化學反應大概要多少時間才完成。我們通常會以某個反應需要花多少時間完成來衡量它是快還是慢:如果所花的時間很短就完成反應,我們就說這個反應的反應速率很高;如果所花的時間很長才完成反應,這個反應的反應速率很低。
| 化學反應 | 反應速率 |
|---|---|
| 氫和氧的反應 | 極高,一瞬間就完成 |
| 鈉和水的反應 | 高,數分鐘就完成 |
| 鋅和水的反應 | 一般,數十分鐘至數小時內完成 |
| 蔗糖的發酵 | 緩慢,數星期完成 |
| 鐵的鏽蝕 | 極慢,需時數月 |
一個化學反應的速率就是量度該反應隨著時間變化的反應程度。
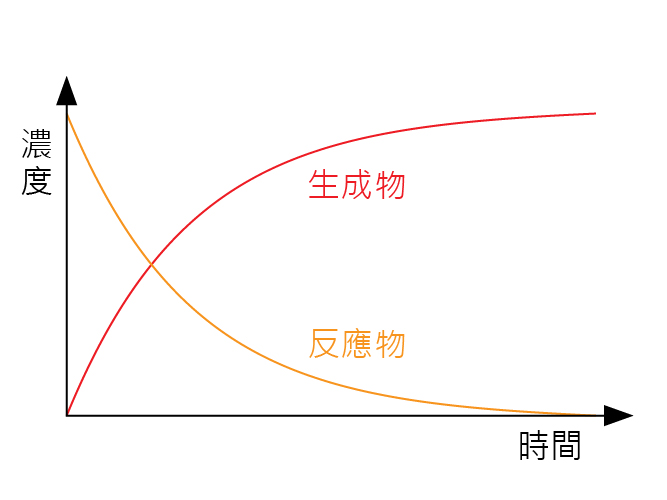
當化學反應發生,反應物會被轉化為生成物。從另一個角度來說,反應物的數量(或是濃度)會隨著時間而下降;而生成物的數量(或濃度)會隨著時間而上升。
不論我們是從「反應物的消耗」還是「生成物的累積」的角度看待化學反應速率,我們都是在描述同一個化學反應。因此,我們可以把化學反應速率量化:
\(\displaystyle \text{化學反應速率=}\frac{\text{反應物或生成物的數量或濃度變化}}{\text{時間}}\)
反應速率的單位通常是 \(\rm{mol}\;\rm{s}^{-1}\),即每秒鐘反應物或生成物的摩爾數的變化,又或是 \(\rm{mol}\;\rm{dm}^{-3}\;\rm{s}^{-1}\),即每秒鐘反應物或生成物濃度的變化。
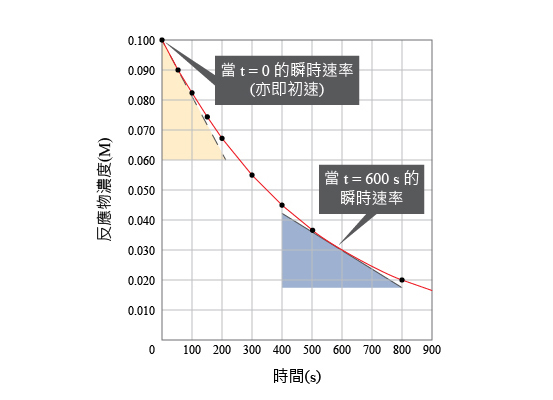
當一個反應在非常短暫的時間內發生,其反應速率便可以用瞬時速率(即在某特定時間的反應速率)來表示。
換言之,當一段時間 (\(\Delta t\)) 趨向零時(即是很短暫),我們便可得出在該特定時間的反應速率。從數學角度而言,這可以用以下公式表示:\(\displaystyle \underset{\Delta t\to \infty }{\mathop{\lim }}\,\left( \frac{\Delta c}{\Delta t} \right)=\frac{dc}{dt}\)
瞬時速率就是指反應在特定時間的反應速率。
大部份情況下,化學反應開始時的反應速率最高,反應速率隨時間而下降;直至反應完結,反應速率為零。
有系統地使用這個模擬器,探討反應速率隨著時間的變化。
初速就是指一個反應在起始階段 (即是 \(t_{0}\)) 的速率。
通常,一個反應的初速是這個反應在任何時候最高的瞬時速率,因為在反應剛開始的時候,反應物的濃度是最高,所以這個時段的反應速率是最高。
