有沒有留意到某些化學反應十分激烈,只消數分鐘就會完成,例如鈉與水的反應;另一些則十分緩慢,需要數月才會看見轉變,例如鐵的鏽蝕。
我們可回想日常生活中的化學反應大概要多少時間才完成。我們通常會以某個反應需要花多少時間完成來衡量它是快還是慢:如果所花的時間很短就完成反應,我們就說這個反應的反應速率很高;如果所花的時間很長才完成反應,這個反應的反應速率很低。
| 化學反應 | 反應速率 |
|---|---|
| 氫和氧的反應 | 極高,一瞬間就完成 |
| 鈉和水的反應 | 高,數分鐘就完成 |
| 鋅和水的反應 | 一般,數十分鐘至數小時內完成 |
| 蔗糖的發酵 | 緩慢,數星期完成 |
| 鐵的鏽蝕 | 極慢,需時數月 |
一個化學反應的速率就是量度該反應隨著時間變化的反應程度。
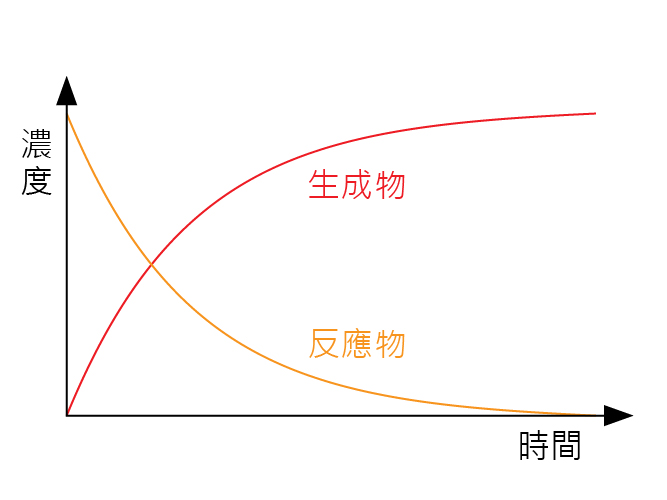
當化學反應發生,反應物會被轉化為生成物。從另一個角度來說,反應物的數量(或是濃度)會隨著時間而下降;而生成物的數量(或濃度)會隨著時間而上升。
不論我們是從「反應物的消耗」還是「生成物的累積」的角度看待化學反應速率,我們都是在描述同一個化學反應。因此,我們可以把化學反應速率量化:
\(\displaystyle \text{化學反應速率=}\frac{\text{反應物或生成物的數量或濃度變化}}{\text{時間}}\)
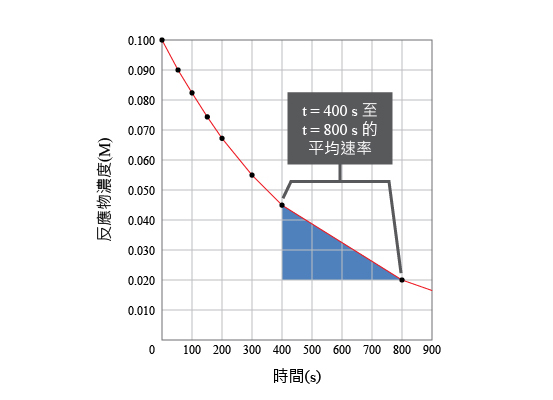
在一個化學反應中,反應物或生成物在一段較長時間內的濃度變化就是平均速率。
例如:在右圖中,找出第 \(400\) 秒至 \(800\) 秒的平均反應速率。
\[\begin{align} & 平均反應速率=\frac{反應物濃度的變化}{時間的變化} \\ & 平均反應速率=\frac{第800s的反應物濃度-第400s的反應物濃度}{800s-400s} \\ & 平均反應速率=\frac{0.020M-0.045M}{800s-400s} \\ & 平均反應速率=-6.25x{{10}^{-5}}M/s \\ \end{align}\]