碰撞理論是一個常用來解釋化學反應速率的理論。根據這個理論,化學反應的發生是因為反應物粒子互相碰撞。
透過以下的動畫,了解碰撞理論。
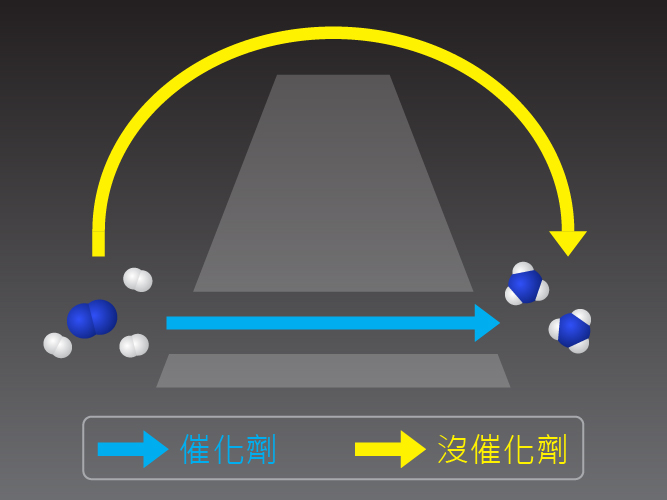
催化劑是一種可改變化學反應速率的物質,但它的化學性質在反應完結時會保持不變。
我們可以用以下比喻理解催化劑的作用:當反應物經過碰撞互相反應,原子重新排列,這個過程需要投入很多能量,這就好比喻為攀山,反應物需要投入能量攀越某個高山,才可完全反應,要是投入的能量不足以攀過高山,則不會發生反應。
而使用催化劑就好比喻為在山腳開通一條隧道,這使反應物行走一條更容易的路線,也能到達目的地,不需要投入太多能量越過高山。
例如氫和氮反應生成氨,但這個反應是非常緩慢,而且產率很低。
\[{{\text{N}}_{\text{2}}}\text{(g) + 3}{{\text{H}}_{\text{2}}}\text{(g)}\underset{{}}{\overset{{}}{\rightleftharpoons}}\text{2N}{{\text{H}}_{\text{3}}}\text{(g)}\]
其後,化學家發現在這個反應加入鐵粉時,反應速率大幅提升。
\[{{\text{N}}_{\text{2}}}\text{(g) + 3}{{\text{H}}_{\text{2}}}\text{(g)}\underset{{}}{\overset{\text{Fe}}{\rightleftharpoons}}\text{2N}{{\text{H}}_{\text{3}}}\text{(g)}\]
但要留意,催化劑只會影響化學反應的速率。
而對於一個可逆反應而言,催化劑既提升正向反應的速率,亦提升逆向反應的速率,但就是不會影響平均位置。
因為一個可逆反應的平衡位置是根據它的平衡常數,而這個平衡常數只取決於反應溫度。
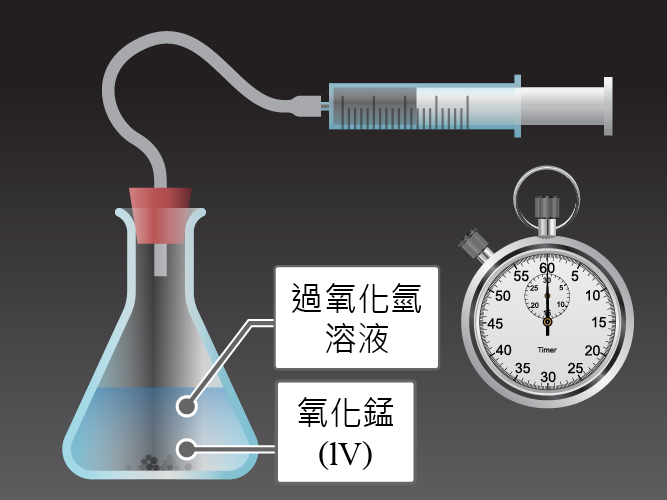
我們可以用過氧化氫(又稱雙氧水,\(\rm{H}_{2}\rm{O}_{2}\))分解為水和氧的反應為例子,探討催化劑在這個反應有甚麼作用。
在常溫常壓下,過氧化氫的分解過程十分緩慢,即使經過幾個月的時間,亦未能完成反應。
\[\text{2}{{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}\text{(aq)}\to \text{2}{{\text{H}}_{\text{2}}}\text{O(l) + }{{\text{O}}_{\text{2}}}\text{(g)}\]
但在加入少量氧化錳(IV)後,這個反應的速率明顯地提升。
\[\text{2}{{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}\text{(aq)}\xrightarrow{\text{少量 M}\text{n}{{\text{O}}_{\text{2}}}}\text{2}{{\text{H}}_{\text{2}}}\text{O(l) + }{{\text{O}}_{\text{2}}}\text{(g)}\]