酸鹼滴定過程中必然伴隨著\(\;\rm{pH}\;\)值的變化,這是因為酸鹼之間的中和作用是涉及氫離子與氫氧離子結合形成水的過程。在酸鹼滴定中,酸和鹼恰好完全反應的那一點稱為當量點;而指示劑剛剛變色的那一點稱為滴定終點。
也就是說,當量點是酸鹼滴定中,酸和鹼剛好完全反應的那一點,是通過儀器測量的結果。而滴定終點則是指示劑剛剛變色的那一點,受指示劑的選擇和人為操作判斷的影響。
根據以上信息,完成右側的題目,比較當量點與滴定終點。
| 酸鹼滴定溶液 | 滴定終點 | 當量點 |
|---|---|---|
| 中和程度 | ||
| \(\rm{pH}\) 值 | ||
| 重複性 |
結論:
滴定終點是指示劑變色的那一點,因此,\(\;\rm{pH}\;\)值和中和程度都由選取的指示劑決定;滴定終點要人為操作控制,所以,不能保證每次實驗的結果完全相同。而當量點則是理論上酸和鹼完全中和的那一點,其\(\;\rm{pH}\;\)值取決於酸鹼的相對強度,不受人為因素影響。
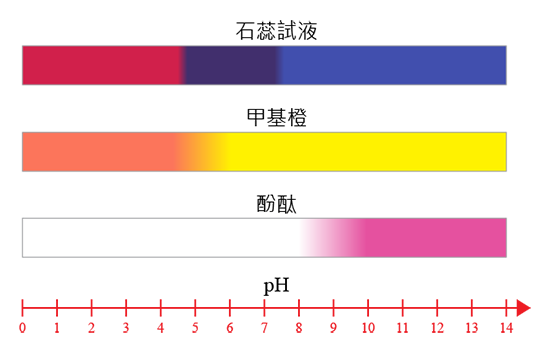
除了\(\;\rm{pH}\;\)感應器或數據收集儀,我們亦可以利用酸鹼指示劑在酸或鹼溶液中呈現不同的顏色,來判定反應是否完成。右側的圖片中,顯示了三種常見指示劑在不同\(\;\rm{pH}\;\)值溶液中的顏色變化,試判斷哪種或哪些指示劑適用於酸鹼滴定?為甚麼?
甲基橙和酚酞比較適用於酸鹼滴定,而石蕊試液則不適用。這是因為甲基橙和酚酞在酸鹼溶液的變色比較明顯;而石蕊試液,在由酸溶液變為鹼溶液時,顏色會由紅色先變為紫色,再變為藍色,而藍色和紫色較難區分,故不宜用作指示劑。
| 指示劑 | 顏色 | 變色範圍的\(\;\rm{pH}\;\)值 | |
|---|---|---|---|
| 酸中 | 鹼中 | ||
| 石蕊 | 紅色 | 藍色 | (紅)\(4.5 \sim 8.3\)(藍) |
| 甲基橙 | 紅色 | 黃色 | (紅)\(3.2 \sim 4.4\)(黃) |
| 酚酞 | 無色 | 粉紅色 | (無)\(8.2 \sim 10.0\)(粉紅) |