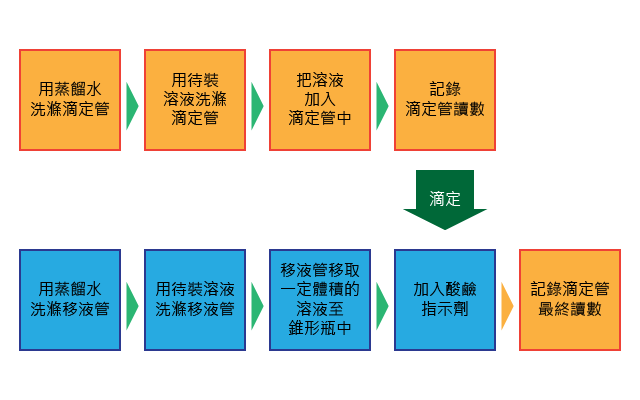
我們將以一已知濃度的氫氧化鈉標準溶液,滴定未知濃度的稀氫氯酸為例,詳細介紹酸鹼滴定完整的操作過程。點擊相應的步驟,以觀看具體操作。
在酸鹼滴定實驗中,某同學進行了四次操作。下表中記錄了該同學實驗前後滴定管的讀數,根據下表數據,計算平均滴定值。
| 滴定管讀數 \(\left( \text{c}{{\text{m}}^{3}} \right)\) | 起始讀數 | 最終讀數 | 所需體積 | 是否有效 |
|---|---|---|---|---|
| 第一次 | \(0.80\) | \(23.35\) | ||
| 第二次 | \(0.32\) | \(22.90\) | ||
| 第三次 | \(3.56\) | \(27.62\) | ||
| 第四次 | \(6.34\) | \(28.85\) |
根據上述表格中的數據可知,此次滴定的平均值為 \(\text{c}{{\text{m}}^{3}}\)。
提示:
在一滴定實驗中,把 \(\text{25}\text{.0}\ \text{c}{{\text{m}}^{\text{3}}}\) 的 \(0.150\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\) 氫氧化鈉溶液移放至錐形瓶中,與滴定管中的稀氫氯酸進行滴定。數據顯示,三次滴定平均值為 \(\text{22}\text{.55}\ \text{c}{{\text{m}}^{\text{3}}}\)。計算可知,稀氫氯酸的濃度為 \(\text{mol}\ \text{d}{{\text{m}}^{-3}}\)。(答案保留至小數點後第三位。)
題解:
反應涉及的方程式:\[\text{NaOH}\left( \text{aq} \right)\ \text{+}\ \text{HCl}\left( \text{aq} \right)\ \to \ \text{NaCl}\left( \text{aq} \right)\ \text{+}\ {{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\]
可以看出:完全中和時,氫氧化鈉的摩爾數 = 氫氯酸的摩爾數。
\(\text{25}\text{.0}\ \text{c}{{\text{m}}^{\text{3}}}\) 的 \(0.150\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\) 氫氧化鈉溶液中含有氫氧化鈉的摩爾數 \(=\) \[25.0\ \text{c}{{\text{m}}^{3}}\ \times \ 0.150\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\ \text{=}\ 3.75\ \times {{10}^{-3}}\ \text{mol}\]
所以, \[\begin{align} \text{氫氯酸的濃度} &= \frac{\text{氫氯酸的摩爾數}}{\text{氫氯酸的體積}}\ \text{=}\ \frac{\text{氫氧化鈉的摩爾數}}{\text{氫氯酸的體積}}\ \\ &= \frac{\text{3}\text{.75}\ \times \ \text{1}{{\text{0}}^{-3}}\ \text{mol}}{\text{22}\text{.55}\ \text{c}{{\text{m}}^{\text{3}}}}\ \text{=}\ 0.166\ \text{mol}\ \text{d}{{\text{m}}^{-3}} \\ \end{align}\]