

中和作用一定是放熱過程。因此,除了酸鹼指示劑(\(\rm{pH}\) 值)外,我們亦可以通過量度混合溶液的溫度變化來測定滴定的當量點。這是因為,隨著反應的進行,混合物的溫度會持續升高,而達至當量點後,由於沒有中和熱的產生,隨著過量試劑的加入,混合物的溫度將下降。
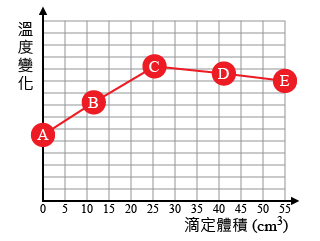
右側的模擬實驗中,展示了氫氯酸與氫氧化鈉溶液滴定時溫度的變化,根據模擬結果回答下列問題。
為甚麼量度酸鹼滴定過程中的溫度變化要在發泡膠杯中進行?
為甚麼滴定曲線顯示混合物的溫度先升高後降低?
圖中代表此次實驗的當量點的是 ?
題解:
達至當量點時,混合物的溫度最高。
根據上圖所示,恰好完全中和時,加入的酸的體積是 \(\text{c}{{\text{m}}^{\text{3}}}\)。(答案保留至整數部分)
題解:
達至當量點時,即為酸鹼恰好完全中和。
若已知發泡膠杯中盛裝的是 \(\text{50}\text{.0}\ \text{c}{{\text{m}}^{\text{3}}}\) 的濃度為 \(0.15\ \text{mol}\ \text{d}{{\text{m}}^{-\text{3}}}\) 的氫氧化鈉溶液,那麼根據上圖所示的滴定結果可知,氫氯酸的濃度為 \(\text{mol}\ \text{d}{{\text{m}}^{-\text{3}}}\)。(答案保留至小數點後兩位)
題解:
氫氧化鈉與氫氯酸反應時,摩爾比為 \(1:1\)。即達至當量點時,兩者的摩爾數相等。所以,
\[\left[ \text{HCl}\left( \text{aq} \right) \right]=\frac{0.15\ \text{mol}\ \text{d}{{\text{m}}^{-1}}\times 50.0\ \text{c}{{\text{m}}^{3}}}{25.0\ \text{c}{{\text{m}}^{3}}}=0.30\ \text{mol}\ \text{d}{{\text{m}}^{-1}}\]