在化學反應中,金屬傾向於失去電子,而非金屬傾向於得到電子。這項化學性質可以用八隅體規則來解釋。
八隅體規則告訴我們:當原子具有八隅體或電子偶的電子結構時,元素會變得穩定。也就是說,除了貴氣體外的元素通常不太穩定,它們的原子傾向於通過化學反應得到或失去電子,以獲得八隅體或電子偶的電子結構。
金屬原子的最外層電子數目較少,在化學反應中,它們傾向於失去最外層電子,以獲得八隅體或電子偶結構。
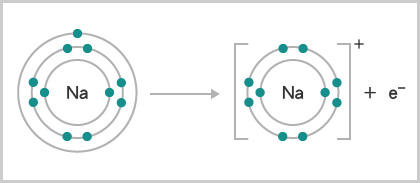
例如,鈉原子的電子排佈是 \((2,8,1)\)。在化學反應中,鈉原子很容易失去 \(1\) 個最外層電子,以達到 \((2,8)\) 的電子排佈。因此,鈉是很活潑的金屬。
非金屬原子的的最外層電子數目較多,在化學反應中,它們傾向於得到電子,以獲得八隅體或電子偶結構。
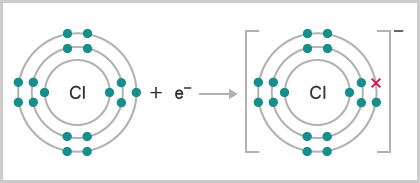
例如,氯原子的電子排佈是 \((2,8,7)\)。在化學反應中,氯原子很容易得到 \(1\) 個最外層電子,以達到 \((2,8,8)\) 的電子排佈。因此,氯是活潑的非金屬。
由此可見,影響或決定元素化學性質的因素是其原子的最外層電子數目。