一般而言,同族元素的原子具有相同數目的最外層電子。因此,為獲得八隅體或電子偶的電子結構,它們在化學反應中所需得到或失去的電子數目相同。這是同族元素的化學性質非常相似的原因。
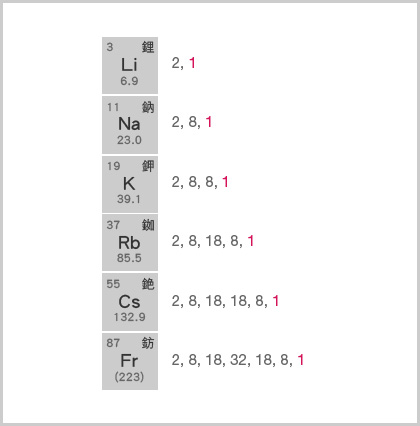
例如,鹼金屬原子都具有 \(1\) 個最外層電子。在化學反應中,它們均傾向於失去這個電子,以獲得八隅體或電子偶的結構。由於在化學反應中,鹼金屬原子所失去的電子數目相同,因此,它們的化學性質十分相似。
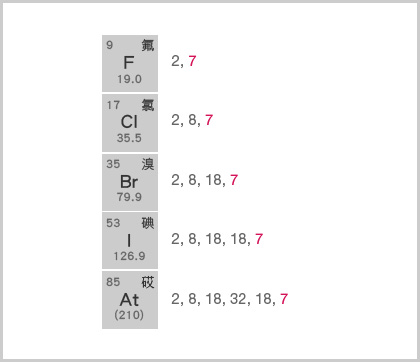
又如,鹵素原子都具有 \(7\) 個最外層電子。在化學反應中,它們均傾向於得到 \(1\) 個外來電子,以獲得八隅體或電子偶的結構。由於在化學反應中,鹵素原子所得到的電子數目相同,因此,它們的化學性質十分相似。
元素活性的高低,與其原子得失電子的難易程度有關。原子得到或失去電子愈容易,元素的活性愈高。
而原子失去電子的難易,取決於原子核與電子之間靜電吸引力的大小。這種靜電吸引力與兩個因素有關:(1) 有效核電荷; (2) 原子核與電子之間的距離。 若有效核電荷愈大,且原子核與電子之間的距離愈小,則原子核與電子之間的吸引力愈大,原子愈難以失去電子。
有效核電荷 (effective nuclear charge) 描述的是吸引外層電子的淨正電荷。它可以用下面的方法粗略地進行估算:
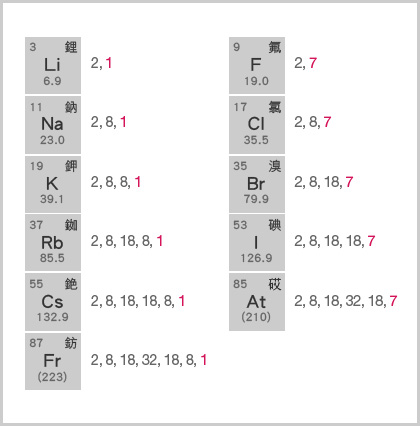
\[\text{有效核電荷 $=$ 核電荷數 $−$ 內層電子數目}\]同族元素具有相同的有效核電荷。
例如,鹼金屬的有效核電荷均為 \(+1\),鹵素的有效核電荷均為 \(+7\)。。
\(\ce{Li}\) 的有效核電荷\( = +3 − 2 = +1\);
\(\ce{Na}\) 的有效核電荷\( = +11 − 10 = +1\);
\(\ce{K }\) 的有效核電荷 \(= +19 − 18 = +1\);
\(\ce{Rb}\) 的有效核電荷\( = +37 − 36 = +1\);
\(\ce{Cs }\) 的有效核電荷 \(= +55 − 54 = +1\)。
\(\ce{F}\) 的有效核電荷 \(= +9 − 2 = +7\);
\(\ce{Cl}\) 的有效核電荷 \(= +17 − 10 = +7\);
\(\ce{Br}\) 的有效核電荷\( = +35 − 28 = +7\);
\(\ce{I}\) 的有效核電荷 \(= +53 − 46 = +7\)。
在化學反應中,鹼金屬原子傾向於失去 \(1\) 個最外層電子,以獲得八隅體或電子偶的結構。
由於有效核電荷相同,而原子核與最外層電子之間的距離,由上至下,逐漸增大,因此,由上至下,鹼金屬的原子核與最外層電子之間的吸引力逐漸減弱,原子失去電子變得愈來愈容易。
原子愈容易失去電子,該元素的活性愈高。因此,鹼金屬的活性,由上至下,逐漸增強。
在化學反應中,鹵素原子傾向於得到 \(1\) 個外來電子,以獲得八隅體的結構。
由於有效核電荷相同,而原子核與最外層電子之間的距離,由上至下,逐漸增大,因此,由上至下,鹵素的原子核與外來電子之間的吸引力逐漸減弱,原子得到電子變得愈來愈困難。
原子愈難得到電子,該元素的活性愈低。因此,鹵素的活性,由上至下,逐漸減弱。