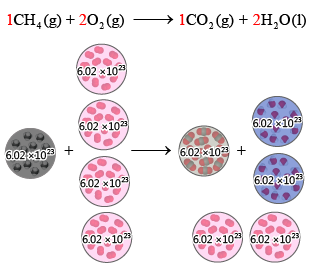
在化學反應中,反應物通常不止一種。若已知的是兩種或以上反應物的量,應該以哪一種反應物的量爲準,來計算生成物的理論產量呢?例如,\(1 \text{ mol}\) 甲烷與 \(4 \text{ mol}\) 氧反應,會生成多少二氧化碳和水呢?
在化學反應中,各種反應物是按照固定的摩爾比進行反應的。如圖所示,雖然氧增加至 \(4 \text{ mol}\),但由於 \(1 \text{ mol}\) 甲烷完全反應,只能消耗 \(2 \text{ mol}\) 氧,因此,有 \(2 \text{ mol}\) 氧,因為再沒有多餘的甲烷可供反應,而被剩餘下來。反應後,仍只能得到 \(1 \text{ mol}\) 二氧化碳和 \(2 \text{ mol}\) 水。
在化學反應中,先被消耗完畢的反應物會限制生成物的量,這種反應物稱為限量反應物 (limiting reactant)。
由於限量反應物的量決定了生成物的產量,因此,若已知多種反應物的量,首先要判斷哪種反應物是限量反應物,才能進行化學計量運算。
判斷限量反應物的方法如下:
寫出平衡的化學反應式。
計算出已知的各種反應物的摩爾數。
假設反應物 A 完全反應,根據化學反應式中的係數比,計算出消耗的反應物 B 的摩爾數。
將實際提供的 B 的摩爾數與計算得出的 B 的摩爾數進行比較,若實際提供的 B 的摩爾數較小,則 B 是限量反應物;反之,A 是限量反應物。
在電爐中,碳和二氧化硅可發生如下反應:
\[\ce{2C(s) + SiO2(s) -> SiC(s) + CO2(g)}\] 若 \(40.0 \text{ g}\) 碳與 \(40.0 \text{ g}\) 二氧化硅在電爐中進行上述反應,哪種物質是限量反應物?假設一種反應物完全反應,計算所消耗的另一種反應物的摩爾數。
假設二氧化硅完全反應,由化學反應式可知,\(n(\ce{C}) : n(\ce{SiO2}) = 2:1 \),因此,
\[\begin{align} n(\ce{C}) &= 2 \times n(\ce{SiO2})\\ &= 2 \times 0.666 \text{ mol}\\ &= 1.33 \text{ mol} \end{align}\]將實際提供的碳的摩爾數與計算得出的碳的摩爾數進行比較,判斷限量反應物。
實際提供的 \(n(\ce{C}) = 3.33 \text{ mol} > 1.33 \text{ mol} \),因此,碳過量,二氧化硅是限量反應物。