平衡的化學反應式能反映出反應物和生成物之間相對的量。以甲烷完全燃燒的反應為例,
\[\ce{CH4(g) + 2O2(g) -> CO2(g) + 2H2O(l)} \]我們可以從微觀角度來描述這一反應:\(1 \) 個甲烷分子與 \(2 \) 個氧分子反應,生成 \(1 \) 個二氧化碳分子和 \(2\) 個水分子。
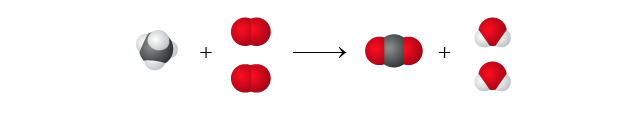
由於粒子的個數和它的摩爾數成正比,因此,我們亦可以從宏觀角度描述這一化學反應:\(1 \text{ mol}\) 甲烷與 \(2 \text{ mol}\) 氧反應,生成 \(1 \text{ mol}\) 二氧化碳和 \(2 \text{ mol}\) 水。
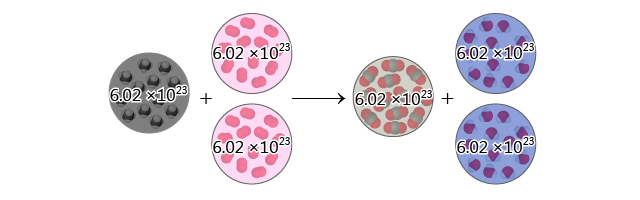
若 \(1 \text{ mol}\) 甲烷與 \(2 \text{ mol}\) 氧反應,可生成 \(1 \text{ mol}\) 二氧化碳和 \(2 \text{ mol}\) 水,則 \(2 \text{ mol}\) 甲烷與 \(4 \text{ mol}\) 氧反應,生成 \(2 \text{ mol}\) 二氧化碳和 \(4 \text{ mol}\) 水;\(3 \text{ mol}\) 甲烷與 \(6 \text{ mol}\) 氧反應,生成 \(3 \text{ mol}\) 二氧化碳和 \(6 \text{ mol}\) 水,以此類推。即在化學反應中,消耗的反應物的摩爾數與得到的生成物的摩爾數之比,等於它們在反應式中的係數比。
\[\color{red}{1}\ce{CH4(g) +} \color{red}{2}\ce{O2(g) -> }\color{red}{1}\ce{CO2(g) +} \color{red}{2}\ce{H2O(l)} \]用一氧化碳還原氧化鐵(III)的反應如下:
\[\ce{Fe2O3(s) + 3CO(g) -> 2Fe(s) + 3CO2(g)}\]若要製備 \(0.0269 \text{ mol}\) 鐵,至少要提供多少摩爾氧化鐵(III)?
題解:
由平衡的化學反應式可知,\(n(\ce{Fe2O3}) : n(\ce{Fe}) = 1:2 \),因此,
\[\begin{align} n(\ce{Fe2O3}) &= \frac{1}{2} \times n(\ce{Fe})\\ &= \frac{1}{2} \times 0.0269 \text{ mol} \\ & = 0.0135 \text{ mol} \end{align}\]