根據質量守恆定律,物質不能被創造或被毀滅,它只能從一種形式轉化為另一種形式。化學反應過程可視作反應物中的化學鍵被破壞,各種原子重新組合,形成生成物中的化學鍵的過程。
因此,化學反應遵循質量守恆定律,即在化學反應前後,原子的種類和數目應保持不變。這一原則同樣反映於化學反應式中:在化學反應式兩側,原子的種類和數目相等。
例如,在甲烷完全燃燒的反應式兩側均含有三種原子——碳原子、氫原子和氧原子,且碳原子的數目均是 \(1\)、氫原子的數目均是 \(4\),氧原子的數目均是 \(4\)。
\[\ce{CH4(g) + 2O2(g) -> CO2(g) + 2H2O(l)} \]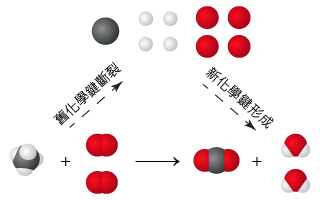
運載火箭的動力可以由化合物 \(\ce{X}\) 分解產生的氣體提供。 \(\ce{X}\) 分解時發生的反應如下:
\[\ce{2X(s) -> N2(g) + Cl2(g) + 4H2O(g) + 2O2(g)}\]\(\ce{X}\) 的化學式是甚麼?
題解:
在化學反應式兩側,原子種類和數目完全相等。在上述反應式中,共有 \(2\) 個 \(\ce{N}\) 原子、\(2\) 個 \(\ce{Cl}\) 原子、\(8\) 個 \(\ce{H}\) 原子和 \(8\) 個 \(\ce{O}\) 原子,因此,右側亦應有同樣數目的這四種原子。
| \(\ce{2X(s)}\) | \(\ce{->}\) | \(\ce{N2(g) + Cl2(g) + 4H2O(g) + 2O2(g)}\) |
| \(2\) 個 \(\ce{N}\) \(2\) 個 \(\ce{Cl}\) \(8\) 個 \(\ce{H}\) \(8\) 個 \(\ce{O}\) |
由於 \(\ce{X}\) 的係數是 \(2\), 因此,\(\ce{X}\) 的化學式中應含有 \(1\) 個 \(\ce{N}\) 原子、\(1\) 個 \(\ce{Cl}\) 原子、\(4\) 個 \(\ce{H}\) 原子和 \(4\) 個 \(\ce{O}\) 原子,即 \(\ce{X}\) 的化學式是 \(\ce{NH4ClO4}\)。