有些碳化合物只由碳和氫兩種元素,或碳、氫和氧三種元素組成。利用這類碳化合物與充足的氧完全反應,生成二氧化碳和水的反應,可測定其中碳、氫及氧的質量,從而計算出它的實驗式。
\[\ce{碳化合物 + 氧 ->[點燃] 二氧化碳 + 水}\]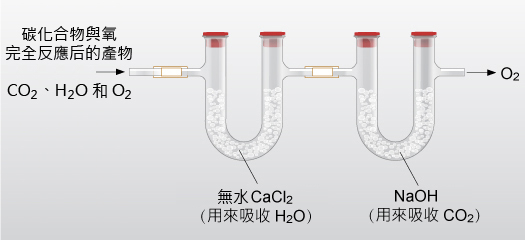
實驗步驟如下:
稱取一定質量的碳化合物,令其與充足的氧反應,全部轉化成 \(\ce{CO2 (g)}\) 和 \(\ce{H2O (g)}\)。
將反應後的混合氣體,通入裝有無水氯化鈣固體的 U 型管。無水氯化鈣會吸收混合氣體中 \(\ce{H2O (g)}\) ,而導致 U 型管質量增加。因此,這個 U 型管在反應後增加的質量即是 \(\ce{H2O (g)}\) 的質量。因為碳化合物中的 \(\ce{H}\) 全部轉化成 \(\ce{H2O (g)}\),所以,由生成的水的質量,我們可計算出碳化合物中氫的質量。
再將混合氣體繼續通入裝有 \(\ce{NaOH}\) 固體的 U 型管,\(\ce{NaOH}\) 固體能吸收混合氣體中的 \(\ce{CO2 (g)}\) 而導致 U 型管質量增加。因此,這個 U 型管在反應後增加的質量即是 \(\ce{CO2 (g)}\) 的質量。因為碳化合物中的 \(\ce{C}\) 全部轉化為 \(\ce{CO2 (g)}\),所以,由生成的 \(\ce{CO2 (g)}\) 的質量,我們可計算出碳化合物中碳的質量。
氧的質量 = 總質量 − 氫的質量 − 碳的質量。
根據碳、氫和氧的質量,計算實驗式。
碳化合物 \(\ce{X}\) 由碳、氫和氧三種元素組成。某同學稱取了 \(0.551 \text{ g}\) 碳化合物 \(\ce{X}\),令其與充足的氧反應。然後,將反應得到的混合氣體,通入如上圖所示的裝置中。經測定,在通入氣體後,裝有無水氯化鈣固體的 U 型管的質量增加了 \(0.648 \text{ g}\),裝有 \(\ce{NaOH}\) 固體的 U 型管的質量增加了 \(1.052 \text{ g}\)。計算 \(\ce{X}\) 的實驗式。
題解:
首先,根據實驗數據,找出各元素的質量。
\(\ce{CO2 (g)}\) 的質量 = 裝有 \(\ce{NaOH}\) 固體的 U 型管增加的質量 = \(1.052 \text{ g}\)
\(\ce{H2O (g)}\) 的質量 = 裝有無水氯化鈣固體的 U 型管增加的質量 = \(0.648 \text{ g}\)
由於碳化合物 \(\ce{X}\) 中的 \(\ce{C}\) 全部轉化為 \(\ce{CO2 (g)}\),因此,\(\ce{X}\) 中的 \(\ce{C}\) 的質量 = 生成的 \(\ce{CO2 (g)}\) 中 \(\ce{C}\) 的質量。
\[\begin{align} \text{C 的質量} & = 1.052 \text{ g} \times \frac{12.0}{44.0} \\ & = 0.287 \text{ g} \end{align}\]類似地,碳化合物 \(\ce{X}\) 中的 \(\ce{H}\) 全部轉化為 \(\ce{H2O (g)}\),因此,\(\ce{X}\) 中的 \(\ce{H}\) 的質量 = 生成的 \(\ce{H2O (g)}\) 中 \(\ce{H}\) 的質量。
\[\begin{align} \text{H 的質量} & = 0.648 \text{ g} \times \frac{2.0}{18.0} \\ & = 0.0720 \text{ g} \end{align}\]\(\therefore \; \ce{O}\) 的質量 \(= 0.551 \text{ g}- 0.287 \text{ g} - 0.0720 \text{ g} = 0.192 \text{ g}\)
然後,根據各元素的質量,確定實驗式。
| \(\ce{C}\) | \(:\) | \(\ce{H}\) | \(:\) | \(\ce{O}\) | 1. 確定化合物中的各種元素。 | |
| \(0.287 \text{ g}\) | \(:\) | \(0.0720 \text{ g}\) | \(:\) | \(0.192 \text{ g}\) | 2. 找出質量比。 | |
| \(\frac{0.287 \text{ g}}{12.0 \text{ g mol}^{-1}}\) | \(:\) | \(\frac{0.0720\text{ g}}{1.0 \text{ g mol}^{-1}}\) | \(:\) | \(\frac{0.192 \text{ g}}{16.0 \text{ g mol}^{-1}}\) | 3. 將質量比換算為摩爾比。 | |
| \(0.0239 \text{ mol}\) | \(:\) | \(0.0720 \text{ mol}\) | \(:\) | \(0.0120 \text{ mol}\) | 4. 將摩爾比化簡成最簡整數比。 | |
| \(2\) | \(:\) | \(6\) | \(:\) | \(1\) | ||
| \(\therefore\) \(\ce{X}\) 的實驗式是 \(\ce{C2H6O}\)。 | 5. 根據最簡整數比,寫出實驗式。 | |||||