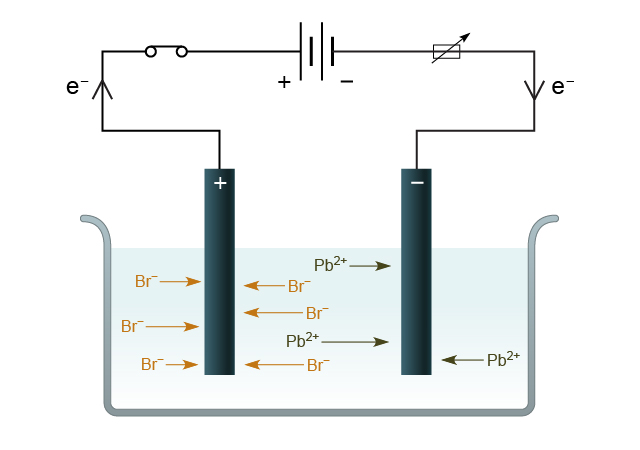
電解,顧名思義,即是用電進行分解。當電流通入熔融的電解質 (或電解質的水溶液) 時,電能會迫使氧化反應和還原反應在陽極和陰極上發生,這個過程即是電解 (electrolysis)。
例如,在電解熔融溴化鉛(II)時,會生成鉛和溴。
\[\ce{PbBr2 (l) -> Pb(l) + Br2(g)} \]在這個電解反應中,陰極和陽極上都發生了怎樣的反應呢?
將陰極反應和陽極反應合併後,可以得到在電解過程中發生的總反應:
\[\ce{Pb^2+ (l) + 2Br^- (l) -> Pb(l) + Br2(g)} \]電解過程中,所有陽離子所獲得的電子總數等於所有陰離子失去的電子總數。