我們學會了在實驗室內製備碳化合物的四個步驟:
設計合成路線;
進行反應以獲取反應生成物;
把生成物從反應混合物中分離及提純;
計算生成物的百分產率。

但當進入實驗室後,我們要把這四個步驟串連起來,才可獲得高純度的生成物。每個化學反應涉的反應物、試劑和生成物都不同,而合成路線所涉及的試劑就更多,因此提純的步驟亦因應需要而調整。
在執行整個合成路線時,我們要先收集合成路線中所涉及的化合物之基本資料,如分子量、密度、沸點、溶點和化學性質。然後,決定反應物的份量,計算摩爾數。
例如製備乙酸乙酯把 \(5.0\;\rm{g}\) 乙酸和 \(10.0\;\rm{g}\) 乙醇倒入一個梨形燒瓶,並加入 \(0.1\;\rm{g}\) 濃硫酸,然後回流加熱。

| 乙酸 | 乙醇 | 濃硫酸 | 乙酸乙酯 | 水 | |
|---|---|---|---|---|---|
| 分子量(\(\text{g mol}^{-1}\)) | \(60.1\) | \(46.7\) | \(97.1\) | \(88.1\) | \(18.0\) |
| 份量(\(\rm{g}\)) | \(5.0\) | \(10.0\) | \(0.1\) | \(7.3\) | \(1.5\) |
| 摩爾數(\(\rm{mol}\)) | \(0.0832\) | \(0.214\) | \(0.00103\) | \(0.0832\) | \(0.0832\) |
| 沸點(\(^\circ \rm{C}\)) | \(118\) | \(78\) | \(337\) | \(77\) | \(100\) |
| 熔點(\(^\circ \rm{C}\)) | \(16\) | \(-11\) | \(10\) | \(-84\) | \(0\) |
| 密度(\(\rm{gcm}^{-3}\)) | \(1.05\) | \(0.79\) | \(1.84\) | \(0.90\) | \(1.00\) |
在填寫反應物和試劑的基本資料後,先判斷哪一個是限量試劑,然後再推算生成物的理論摩爾數和理論產量。
在製造乙酸乙酯時,把乙酸、乙醇和濃硫酸都倒進梨形燒瓶,然後回流加熱約 \(45\) 分鐘,這樣便生成乙酸乙酯。
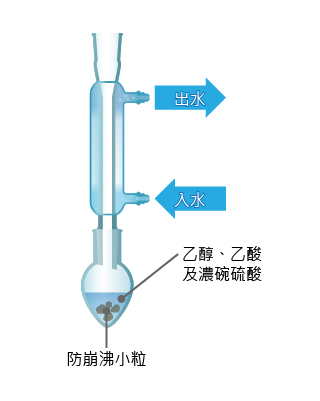
雖然反應混合物中包含乙酸乙酯,但亦有其他雜質,例如乙酸、乙醇、水和濃硫酸。
觀看以下影片,學習如何運用合適的提純方法,獲得高純度的乙酸乙酯。
我們之前把 \(5.0\;\rm{g}\) 乙酸和 \(10.0\;\rm{g}\) 乙醇倒入一個梨形燒瓶,並加入 \(0.1\;\rm{g}\) 濃硫酸,然後回流加熱。假設我們在提純後獲得 \(5.0\;\rm{g}\) 乙酸乙酯,那麼乙酸乙酯的百分產率:
\(\begin{align*} \rm{乙酸乙酯的百分產率} &= \frac{\rm{實際產量}}{\rm{理論產量}} \times 100 \% \\ \\ &= \frac{5.0}{7.3} \times 100 \% \\ \\ &= 68.5 \% \end{align*}\)
假設在提純後獲得 \(6.2\;\rm{g}\) 乙酸乙酯,那麼乙酸乙酯的百分產率又會是多少?
(答案保留一位小數位)
\(\begin{align*} \rm{乙酸乙酯的百分產率} &= \frac{\rm{實際產量}}{\rm{理論產量}} \times 100 \% \\ \\ &= \frac{6.2}{7.3} \times 100 \% \\ \\ &= 85.0 \% \end{align*}\)