烷是由碳—碳單鍵和碳—氫鍵組成的碳氫化合物。烷不含任何官能基。
只由單鍵連結而構成的碳氫化合物,稱為飽和碳氫化合物。因此,烷是飽和碳氫化合物。
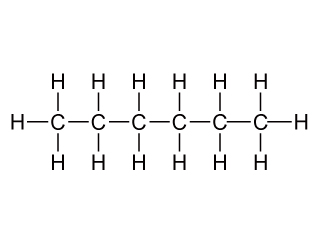
我們可以用球棒模型或填充模型將烷的結構表示出來。
球棒模型就是用球體和長棒分別代表原子和化學鍵,用不同顏色和大小的球體代表不同的原子。
從球棒模型可以清楚地看到烷分子內各原子的連結方式,且碳—碳或碳—氫鍵之間的夾角均約是 \(109.5 ^{\circ}\)。
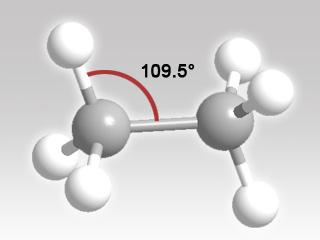
比球棒模型更簡單,只用球體代表原子,球體與球體的直接接觸代表化學鍵,因此填空模型比球棒模型更能反映不同原子之間互相緊貼的程度。

烷只由碳—碳單鍵 (\(\ce{C−C}\)) 和碳—氫鍵 (\(\ce{C−H}\)) 組成,它是結構最簡單的同系列有機化合物。
烷的分子式是有規律可循的,如果一個烷分子含碳的數目為 \(\rm{n}\),則它的分子式就是 \(\rm{C}_{n}\rm{H}_{2n+2}\)。這樣的分子式成為「通式」。因此,
烷的通式是 \(\rm{C}_{n}\rm{H}_{2n+2}\)(\(\rm{n} = 1, 2, 3,......\))
| 名稱 | 分子式 |
|---|---|
| 甲烷 | \(\ce{CH4}\) |
| 乙烷 | \(\ce{C2H6}\) |
| 丙烷 | \(\ce{C3H8}\) |
| 丁烷 | \(\ce{C4H10}\) |
| 戊烷 | \(\ce{C5H12}\) |
| 己烷 | \(\ce{C6H14}\) |
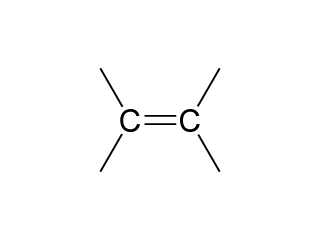
烷的碳—碳和碳—氫之間全部都是單鍵。當烷中的一個碳—碳單鍵變為碳—碳雙鍵的時候,它就是烯了。也就是說,
烯是分子中含有一個碳—碳雙鍵的碳氫化合物。
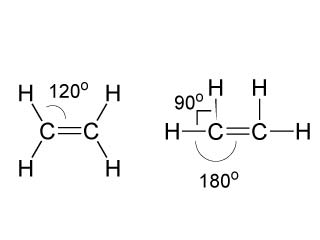
碳—碳雙鍵 (\(\ce{C=C}\)) 與相鄰的單鍵之間的夾角大約是 \(120 ^{\circ}\)。為了書寫方便,有時會將這個夾角寫成 \(90 ^{\circ}\)。
烯與烷相比,只是將烷中的一個碳—碳單鍵變為碳—碳雙鍵,因而含有相同碳數的烯分子比它對應的烷分子少兩個氫原子。
烷分子的通式是 \(\rm{C}_{n}\rm{H}_{2n+2}\),所以,
烯的通式是 \(\rm{C}_{n}\rm{H}_{2n}\) (\(\rm{n} = 2,3,4,......\))
注意,因為碳—碳雙鍵需要兩個碳原子才能形成,所以烯至少含有 \(2\) 個碳原子。也就是說,甲烯是不存在的,乙烯是最簡單的烯。
| 烷 | 烯 |
|---|---|
|
乙烷 (\(\ce{C2H6}\)) \(\ce{CH3CH3}\) |
乙烯 (\(\ce{C2H4}\)) \(\ce{CH2=CH2}\) |
|
丙烷 (\(\ce{C3H8}\)) \(\ce{CH3CH2CH3}\) |
丙烯 (\(\ce{C3H6}\)) \(\ce{CH2=CHCH3}\) |
|
丁烷 (\(\ce{C4H10}\)) \(\ce{CH3(CH2)2CH3}\) |
丁\(-1-\)烯 (\(\ce{C4H8}\)) \(\ce{CH2=CHCH2CH3}\) |
下面的影片,簡單介紹了有機化合物的結構式。
運用同樣的規則亦可根據烯的名稱寫出它的結構式。
下面的表格中,對比了一些烯烴的結構式和簡易結構式,可以看到在烯烴的簡易結構式中雙鍵不能省略。
| 命名 | 結構式 | 簡易結構式 |
|---|---|---|
| 丁\(-1-\)烯 | 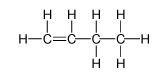 |
\(\ce{CH2=CHCH2CH3}\) |
| 丁\(-2-\)烯 | 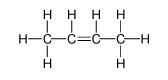 |
\(\ce{CH3CH=CHCH3}\) |
| \(2-\)甲基戊\(-1-\)烯 | 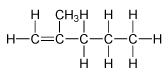 |
\(\ce{CH2=C(CH3)(CH2)2CH3}\) |
| \(2-\)甲基\(-3-\)乙基戊\(-2-\)烯 | 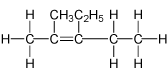 |
\(\ce{(CH3)2C=C(CH2CH3)2}\) |
下面的表格中展示一些直鏈烷的物理性質。
| 烷 | 結構式 | 熔點(\(^{\circ} \rm{C}\)) | 沸點(\(^{\circ} \rm{C}\)) | 密度(\(\text{g cm}^{−3}\)) | 水溶性 |
|---|---|---|---|---|---|
| 甲烷 | \(\ce{CH4}\) | \(−182\) | \(−162\) | \(0.47\) | 不溶於水 |
| 乙烷 | \(\ce{CH3CH3}\) | \(−183\) | \(−89\) | \(0.57\) | 不溶於水 |
| 丙烷 | \(\ce{CH3CH2CH3}\) | \(−190\) | \(−42\) | \(0.59\) | 不溶於水 |
| 丁烷 | \(\ce{CH3CH2CH2CH3}\) | \(−138\) | \(−0.5\) | \(0.60\) | 不溶於水 |
| 戊烷 | \(\ce{CH3CH2CH2CH2CH3}\) | \(−130\) | \(36\) | \(0.63\) | 不溶於水 |
| 己烷 | \(\ce{CH3CH2CH2CH2CH2CH3}\) | \(−95\) | \(69\) | \(0.65\) | 不溶於水 |
烷的物理性質可以總結如下:
下面的表格中展示一些雙鍵的位置相同的直鏈烯的物理性質。
| 烯 | 簡易結構式 | 熔點 (\(^{\circ} \rm{C}\)) | 沸點 (\(^{\circ} \rm{C}\)) | 水溶性 |
|---|---|---|---|---|
| 乙烯 | \(\ce{CH2=CH2}\) | \(−169\) | \(−102\) | 不溶於水 |
| 丙烯 | \(\ce{CH2=CHCH3}\) | \(−185\) | \(−48\) | 不溶於水 |
| 丁\(-1-\)烯 | \(\ce{CH2=CHCH2CH3}\) | \(−185\) | \(−6\) | 不溶於水 |
| 戊\(-1-\)烯 | \(\ce{CH2=CH(CH2)2CH3}\) | \(−138\) | \(30\) | 不溶於水 |
| 己\(-1-\)烯 | \(\ce{CH2=CH(CH2)3CH3}\) | \(−140\) | \(63\) | 不溶於水 |
烯的物理性質可以總結如下: