碳化合物的種類繁多,現時科學家已發現超過一千萬種不同的碳化合物,而這個數量仍在與日俱增。在日常生活中,我們都接觸到各種不同類型的碳化合物,包括:
究竟是甚麼原因使碳能構成種類繁多的碳化合物呢?本節中,我們就一起來探討碳的獨特性!

特性一:碳原子之間可以互相連結,形成不同的碳鏈
碳原子之間可以互相連結,形成不同形狀或不同長度的碳鏈。
碳鏈的長度極具彈性,短則由三、四個碳原子構成,長則由成千上萬的碳原子構成。塑膠(例如聚乙烯)就是擁有極長碳鏈的一類碳化合物。
碳鏈的形狀可以是直鏈(所有的碳原子連續地連結在一起),含支鏈(含有最多碳原子的連續碳鏈上還連結著其他碳原子),又或是環狀結構。
下圖展示的是由六個碳原子組成的不同形狀的碳鏈。
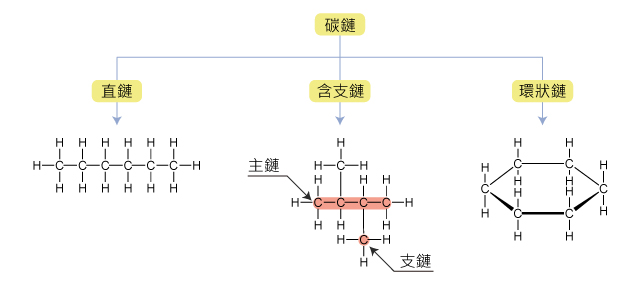
特性二:碳原子的最外層有四個電子,可形成不同類型的共價鍵
下面的影片,從碳原子形成不同類型的共價鍵的角度,解釋了為什麼碳原子可以形成種類繁多的化合物。
特性三:碳原子能與其他元素的原子成鍵
碳是第 IV 族元素,位於元素週期表的中間。它的原子能與多種不同的元素的原子成鍵,常見的如氫、氮、氧、鹵素、硅、磷、硫等等。甚至是過渡金屬,亦可和碳原子形成化學鍵。

日常生活中接觸到的很多化合物的結構內,都含有碳原子和其他元素的原子之間形成的化學鍵。
| 含碳的共價鍵 | 例子 |
|---|---|
| \(\ce{C—H}\) 鍵 |  |
| \(\ce{C—N}\) 鍵 |  |
| \(\ce{C—O}\) 鍵 |  |
\(\ce{C—X}\) 鍵 (\(\ce{X}\) 表示鹵素的原子) |
 |