由於 \(2\) 個原子的分子一定是線形,因此不需要討論。我們主要討論簡單的多原子分子。
每個分子都是獨立而穩定的存在,例如 \(\ce{H2O}\) 和 \(\ce{CO2}\)。但你又有否留意到,儘管 \(\ce{H2O}\) 和 \(\ce{CO2}\) 都是由 \(3\) 個原子所組成,為甚麼 \(\ce{H2O}\) 的形狀是 V 形,而 \(\ce{CO2}\) 是線形呢?「為甚麼它們的分子形狀不同?」
當我們考慮簡單的多原子分子形狀時,可以先找出多原子分子中的中心原子,例如:\(\ce{H2O}\) 的中心原子是 \(\ce{O}\),\(\ce{CO2}\) 的中心原子是 \(\ce{C}\),\(\ce{CH4}\) 的中心原子是 \(\ce{C}\)。
簡單分子的形狀主要取決於中心原子的電子排佈和與它鍵合的原子數目。符合八隅體結構的分子,它的中心原子就擁有 \(8\) 粒最外圍電子,亦即 \(4\) 對電子對,這 \(4\) 對電子對可以是鍵合電子對,也可以是孤電子對。
一般而言,我們可以用價層電子對互斥理論(VSEPR 理論)來預測分子的形式,簡單而言,它是建基於電子互相排斥。中心原子的 \(4\) 對最外圍電子會互相排斥,為了保持分子的穩定,這 \(4\) 對電子對會盡量遠離對方。
孤電子對-孤電子對 > 孤電子對-鍵合電子對 > 鍵合電子對-鍵合電子對
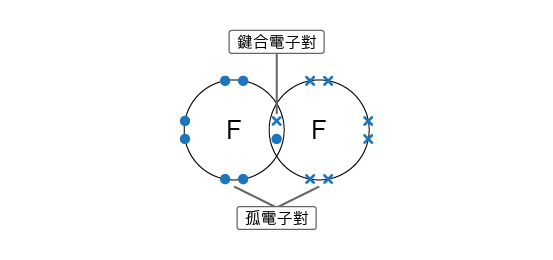
鍵合電子對是指分子中參與共價鍵的電子對,鍵合電子對處於 \(2\) 個原子核中間。
孤電子對是指分子中沒有參與共價鍵的電子對,孤電子對只處於原子上的最外層電子層。
中心原子擁有不同數目的鍵合電子對和孤電子對會導致不同的分子形狀。
符合八隅體結構的分子的中心原子擁有 \(8\) 粒最外圍電子對,而另一些分子不符合八隅體結構,它的中心原子的最外圍擁有多少或少於 \(8\) 粒電子,但基本上還是遵守電子互相排斥的原則,所以電子對會盡量分散。
| 電子對數目 | 鍵合電子對數目 | 孤電子對數目 | 分子形狀 |
|---|---|---|---|
| \(4\) | \(2\) | \(2\) | V 形 |
| \(4\) | \(3\) | \(1\) | 三角錐形 |
| \(3\) | \(3\) | \(0\) | 平面三角形 |
| \(4\) | \(4\) | \(0\) | 四面體形 |
| \(5\) | \(5\) | \(0\) | 三角雙錐形 |
| \(6\) | \(6\) | \(0\) | 八面體形 |