線形是最簡單的分子形狀,大部分線形分子都是由 \(2\) 個或 \(3\) 個原子組成,例如 \(\ce{HCl}\) 和 \(\ce{CO2}\)。
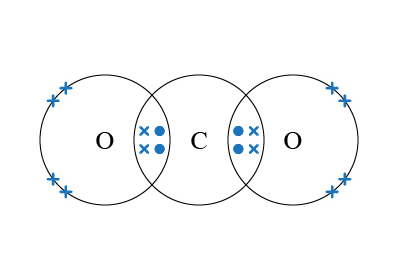
但到 \(3\) 個原子組成的分子時,分子可能是 V 形,又或是線形,這取決於中心原子的電子排佈:例如,\(\ce{CO2}\) 的中心原子是 \(\ce{C}\),它與 \(2\) 個 \(\ce{O}\) 生成 \(2\) 個雙鍵,\(\ce{C}\) 的最外層並沒有孤電子對。電子為了使彼此之間的排斥減至最小,因此會把彼此的距離最大化,形成線形分子,\(\ce{O=C=O}\) 的鍵角是 \(180\) 度。
由於 \(\ce{CO2}\) 只擁有 \(2\) 個共價鍵,\(\ce{H2O}\) 是平面分子。因此,我們只用直線代表共價鍵。
\(\ce{CO2}\) 的中心原子是 \(\ce{C}\),它與 \(2\) 個 \(\ce{O}\) 生成雙鍵,沒有孤電子對。因此 \(\ce{C}\) 的最外層有 \(4\) 對電子對,並分成 \(2\) 組,為了使彼此之間的排斥減至最小,\(\ce{C}\) 的電子對會盡量分開。這就成了直線形。
普通的直線是表示共價鍵是留在原來的平面上。
因為 \(\ce{C}\) 沒有孤電子對,只有 \(2\) 對雙鍵,所以 \(\ce{CO2}\) 是線形。
V 形是簡單的分子形狀,大部分 V 形分子都是由 \(3\) 個原子組成,例如 \(\ce{H2O}\)。
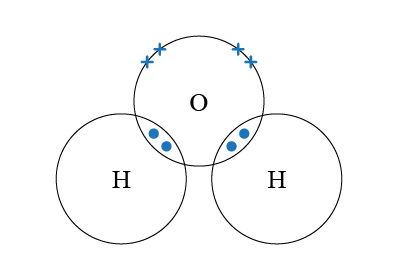
\(\ce{H2O}\) 的中心原子是 \(\ce{O}\),它與 \(2\) 個 \(\ce{H}\) 生成單鍵,同時 \(\ce{O}\) 還有 \(2\) 對孤電子對。因此 \(\ce{O}\) 的最外層有 \(4\) 對電子(\(2\) 對鍵合電子對,\(2\) 對孤電子對)。電子為了使彼此之間的排斥減至最小,\(\ce{O}\) 的 \(4\) 對電子對會盡量分開。這 \(4\) 對電子會排列成近似四面體形,但要緊記,由於孤電子對-孤電子的排斥力 > 孤電子對-鍵合電子對的排斥力 > 鍵合電子對-鍵合電子對的排斥力,因此 \(2\) 對鍵合電子被逼微微靠近。我們描述分子的形狀時,只考慮原子,而不考慮孤電子對。所以 \(\ce{H2O}\) 的形狀是 V 形。
所以,當我們考慮分子結構時,要連中心原子的孤電子對也要考慮;但描述分子形狀時,就只考慮原子,不涉及孤電子對。最簡單的方法就是由分子的電子圖入手。
由於 \(\ce{H2O}\) 只擁有 \(2\) 個共價鍵,\(\ce{H2O}\) 是平面分子。因此,我們只用直線代表共價鍵。
普通的直線是表示共價鍵是留在原來的平面上。
因為 \(\ce{O}\) 的 \(2\) 個弧電子對會影響分子形狀,但就不需要畫出來,所以 \(\ce{H2O}\) 是 V 形,而 \(\ce{H-O-H}\) 鍵角為 \(104.5\) 度。
三角錐體形是簡單的分子形狀,大部分三角錐體形分子都是由 \(4\) 個原子組成,例如 \(\ce{NH3}\)。
\(\ce{NH3}\) 的中心原子是 \(\ce{N}\),它與 \(3\) 個 \(\ce{H}\) 生成單鍵,同時還有 \(1\) 對孤電子對。因此 \(\ce{N}\) 的最外層有 \(4\) 對電子對。電子對為了使彼此之間的排斥減至最小,\(\ce{N}\) 的 \(4\) 對電子對會盡量分開。這 \(4\) 對電子會排列成近似四面體形,但由於孤電子對-鍵合電子對的排斥力大於鍵合電子對-鍵台電子對的排斥力,因此 \(\ce{H-N-H}\) 鍵角被逼由 \(109.5\) 度減至約 \(107\) 度。
當我們要繪畫 \(\ce{NH3}\) 的立體圖時,我們除了會用直線代表共價鍵之外,還會用粗體實線和粗體虛線來表達立體感。
普通的直線是表示共價鍵是留在原來的平面上。
粗體實線表示共價鍵離開平面,靠近我們的方向;粗體虛線表示共價鍵離開平面,疏遠我們的方向。
因此,\(\ce{NH3}\) 有 \(1\) 個共價鍵是用一般直線,\(1\) 個共價鍵是用粗體直線,另 \(1\) 個共價鍵是用粗體虛線表示。
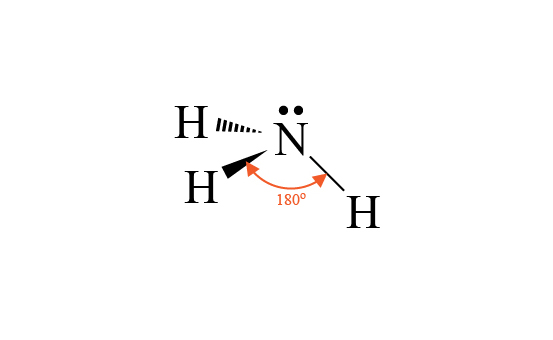
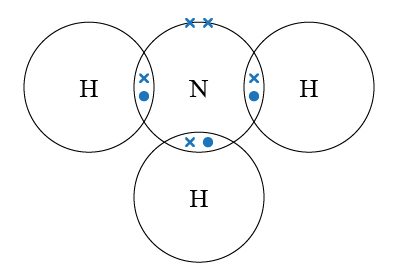
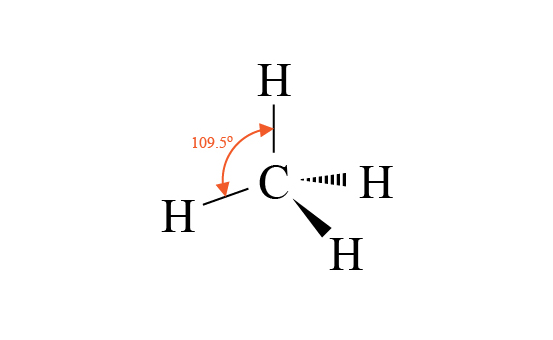
四面體形是簡單的分子形狀,大部分四面體形分子都是由 \(5\) 個原子組成,例如 \(\ce{CH4}\) 和 \(\ce{CCl4}\)。
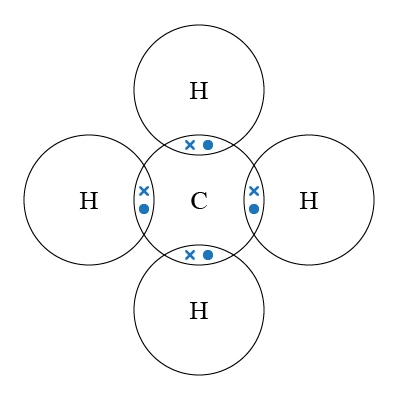
\(\ce{CH4}\) 的中心原子是 \(\ce{C}\),它與 \(4\) 個 \(\ce{H}\) 生成單鍵。因此 \(\ce{C}\) 的最外層有 \(4\) 對鍵合電子對,但就沒有孤電子對。
電子對為了使彼此之間的排斥減至最小,\(\ce{C}\) 的 \(4\) 對電子對會盡量分開。這 \(4\) 對電子對會排列成四面體形,因此 \(\ce{H-C-H}\) 鍵角為 \(109.5\) 度。
在 \(\ce{CH4}\) 的電子圖中,\(\ce{H-C-H}\) 鍵角為僅為 \(90\) 度,(即直角),這是因為電子圖只是平面 (\(\ce{2D}\)) 表示各原子鍵合的情況,但原子是在三維空間 (\(\ce{3D}\)) 鍵合,因此電子圖未必能完全反映分子的真實形狀,所以我們不可單靠電子圖判斷分子形狀。
當我們要繪畫 \(\ce{CH4}\) 的立體圖時,我們除了會用直線代表共價鍵之外,還會用粗體實線和粗體虛線來表達立體感。
普通的直線是表示共價鍵是留在原來的平面上。
粗體實線表示共價鍵離開平面,靠近我們的方向;粗體虛線表示共價鍵離開平面,疏遠我們的方向。
因此,\(\ce{CH4}\) 有 \(2\) 個共價鍵是用一般直線,\(1\) 個共價鍵是用粗體直線,另 \(1\) 個共價鍵是用粗體虛線表示。