陽離子和陰離子之間強大而無方向性的靜電力,就是離子鍵。
因為金屬原子易失去電子形成陽離子,而非金屬原子則易得到電子形成陰離子。所以,當金屬原子與非金屬原子結合時,就會形成離子鍵。
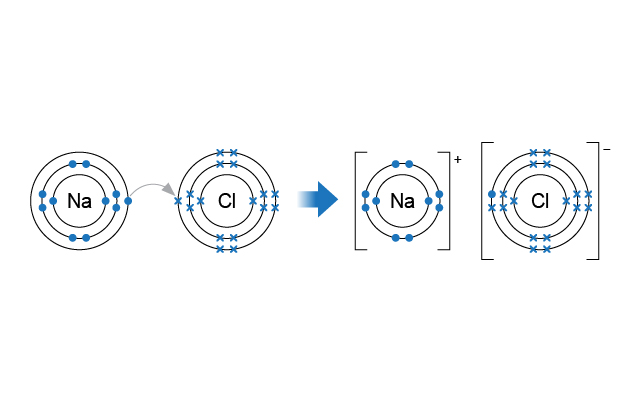
鈉原子的電子排佈是 (\(2,8,1\)),氯原子的電子排佈是 (\(2,8,7\))。為了獲得穩定的電子排佈——八隅體結構,它們會進行電子轉移。
當鈉原子和氯原子相結合,每個鈉原子會失去一個電子,形成鈉離子;而每個氯原子則會得到一個電子,形成氯離子。鈉離子和氯離子之間依靠正負電荷之間的吸引力結合在一起,這種吸引力就是離子鍵。
離子鍵的形成可以用電子圖來表示。
當鈉原子和氯原子相結合時,鈉原子 (\(2,8,1\)) 的一粒最外層電子,轉移至氯原子 (\(2,8,7\)) 的最外層電子層之中。亦即是說,每個鈉原子失去一個電子,形成鈉離子 (\(2,8\)),而每個氯原子得到一個電子形成氯離子 (\(2,8,8\))。鈉離子和氯離子之間依靠正負電荷之間的吸引力結合在一起,這種吸引力就是離子鍵。
注意:雖然鈉原子易於失去電子,但要是沒有另一方接受電子,鈉是不會失去電子的。亦即是說,有供應電子的原子,也要有接受電子的原子,才會形成離子鍵。