我們可根據離子的原子序和質量數,推算離子中的質子、中子和電子數目。
離子的符號包括 \(4\) 項資料:原子序、質量數、元素符號和電荷數。
只要我們掌握以下 \(3\) 條方程式,就可以從離子的符號,推算當中的質子、中子和電子數目。
質量數 = 中子數 + 質子數
質子數 = 原子序
電荷數 = 質子數 − 電子數

我們可從原子序或元素符號中,得知這個離子有 \(11\) 個質子。
然後我們可以推算質量數:
| 質量數 | = | 中子數 + 質子數 |
| \(23\) | = | 中子數 + \(11\) |
| 中子數 | = | \(12\) |
推算電子數:
| 電荷數 | = | 質子數 − 電子數 |
| +\(1\) | = | \(11\) − 電子數 |
| 電子數 | = | \(10\) |
因此,鈉離子擁有 \(11\) 個質子、\(12\) 個中子和 \(10\) 個電子。
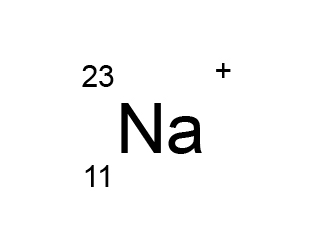
對於主族元素而言,金屬或非金屬元素的原子會藉由化學反應來獲得或失去電子,以達到「八隅體」(或電子偶)的穩定結構。這就是離子形成的原因。
當原子失去電子時,質子的數目多於電子的數目,就會形成帶正電荷的陽離子;當原子獲得電子時,質子的數目少於電子的數目,就會形成帶負電荷的陰離子。一般而言,金屬原子較易失去電子,因此金屬原子較易形成陽離子;非金屬原子較易獲得電子,因此非金屬原子較易形成陰離子。
現在,我們就來推測原子變成陽離子或陰離子的規則,並以族為單位,檢視相對應離子的電荷。
首先,我們要先從模擬中,找出以下原子的電子排佈:
| 第 I 族:鹼金屬 | 電子排佈 |
|---|---|
| 鋰 (\(\ce{Li}\)) | , |
| 鈉 (\(\ce{Na}\)) | , , |
鋰和鈉會透過電子轉移,達到「八隅體」的穩定結構。在元素週期表中,最鄰近鋰和鈉的貴氣體分別是氦和氖。
| 第 \(0\) 族:貴氣體 | 電子排佈 |
|---|---|
| 氦 (\(\ce{He}\)) | |
| 氖 (\(\ce{Ne}\)) | , |
因此,鋰和鈉的原子要失去 \(1\) 粒電子,才可獲得相對應貴氣體的電子排佈。由此可知,鋰離子和鈉離子的電子排佈是:
| 第 I 族:鹼金屬 | 電子排佈 |
|---|---|
| 鋰離子 | |
| 鈉離子 | , |
由此推論,第 I 族元素的原子會生成帶 \(+1\) 電荷的離子。
推測原子變成陽離子或陰離子的規則,並以族為單位,檢視相對應離子的電荷。
首先從模擬中,找出以下原子的電子排佈:
| 第 II 族:鹼土金屬 | 電子排佈 |
|---|---|
| 鈹 (\(\ce{Be}\)) | , |
| 鎂 (\(\ce{Mg}\)) | , , |
鈹和鎂會透過電子轉移,達到「八隅體」的穩定結構。在元素週期表中,最鄰近鈹和鎂的貴氣體分別是氦和氖。
| 第 \(0\) 族:貴氣體 | 電子排佈 |
|---|---|
| 氦 (\(\ce{He}\)) | |
| 氖 (\(\ce{Ne}\)) | , |
因此,鈹和鎂的原子要失去 \(2\) 粒電子,才可獲得相對應貴氣體的電子排佈。由此可知,鈹離子和鎂離子的電子排佈是:
| 第 II 族:鹼土金屬 | 電子排佈 |
|---|---|
| 鈹離子 | |
| 鎂離子 | , |
由此推論,第 II 族元素的原子會生成帶 \(+2\) 電荷的離子。
推測原子變成陽離子或陰離子的規則,並以族為單位,檢視相對應離子的電荷。
首先從模擬中,找出以下原子的電子排佈:
| 第 III 族 | 電子排佈 |
|---|---|
| 鋁 (\(\ce{Al}\)) | , , |
鋁會透過電子轉移,達到「八隅體」的穩定結構。在元素週期表中,最鄰近鋁的貴氣體是氖。
| 第 \(0\) 族:貴氣體 | 電子排佈 |
|---|---|
| 氖 (\(\ce{Ne}\)) | , |
因此,鋁的原子要失去 \(3\) 粒電子,才可獲得相對應貴氣體的電子排佈。由此可知,鋁離子的電子排佈是:
| 第 III 族 | 電子排佈 |
|---|---|
| 鋁離子 | , |
由此推論,第 III 族元素的原子會生成帶 \(+3\) 電荷的離子。
推測原子變成陽離子或陰離子的規則,並以族為單位,檢視相對應離子的電荷。
首先從模擬中,找出以下原子的電子排佈:
| 第 V 族 | 電子排佈 |
|---|---|
| 氮 (\(\ce{N}\)) | , |
| 磷 (\(\ce{P}\)) | , , |
氮和磷會透過電子轉移,達到「八隅體」的穩定結構。在元素週期表中,最鄰近氮和磷的貴氣體分別是氖和氬。
| 第 \(0\) 族:貴氣體 | 電子排佈 |
|---|---|
| 氖 (\(\ce{Ne}\)) | , |
| 氬 (\(\ce{Ar}\)) | , , |
因此,氮和磷的原子要獲得 \(3\) 粒電子,才可獲得相對應貴氣體的電子排佈。由此可知,氮離子和磷離子的電子排佈是:
| 第 V 族 | 電子排佈 |
|---|---|
| 氮離子 | , |
| 磷離子 | , , |
由此推論,第 V 族元素的原子會生成帶 \(−3\) 電荷的離子。
推測原子變成陽離子或陰離子的規則,並以族為單位,檢視相對應離子的電荷。
首先從模擬中,找出以下原子的電子排佈:
| 第 VI 族 | 電子排佈 |
|---|---|
| 氧 (\(\ce{O}\)) | , |
| 硫 (\(\ce{S}\)) | , , |
氧和硫會透過電子轉移,達到「八隅體」的穩定結構。在元素週期表中,最鄰近氧和硫的貴氣體分別是氖和氬。
| 第 \(0\) 族:貴氣體 | 電子排佈 |
|---|---|
| 氖 (\(\ce{Ne}\)) | , |
| 氬 (\(\ce{Ar}\)) | , , |
因此,氧和硫的原子要獲得 \(2\) 粒電子,才可獲得相對應貴氣體的電子排佈。由此可知,氧離子和硫離子的電子排佈是:
| 第 VI 族 | 電子排佈 |
|---|---|
| 氧離子 | , |
| 硫離子 | , , |
由此推論,第 VI 族元素的原子會生成帶 \(−2\) 電荷的離子。
推測原子變成陽離子或陰離子的規則,並以族為單位,檢視相對應離子的電荷。
首先從模擬中,找出以下原子的電子排佈:
| 第 VII 族 | 電子排佈 |
|---|---|
| 氟 (\(\ce{F}\)) | , |
| 氯 (\(\ce{Cl}\)) | , , |
氟和氯會透過電子轉移,達到「八隅體」的穩定結構。在元素週期表中,最鄰近氟和氯的貴氣體分別是氖和氬。
| 第 \(0\) 族:貴氣體 | 電子排佈 |
|---|---|
| 氖 (\(\ce{Ne}\)) | , |
| 氬 (\(\ce{Ar}\)) | , , |
因此,氟和氯的原子要獲得 \(1\) 粒電子,才可獲得相對應貴氣體的電子排佈。由此可知,氟離子和氯離子的電子排佈是:
| 第 VII 族 | 電子排佈 |
|---|---|
| 氟離子 | , |
| 氯離子 | , , |
由此推論,第 VI 族元素的原子會生成帶 \(−1\) 電荷的離子。