阿士匹靈又名為乙酰水楊酸,但其實它的系統命名是 \(2-\)乙酰氧基苯甲酸,因此不難理解阿士匹靈是由酯基、羧基和苯結構而成。
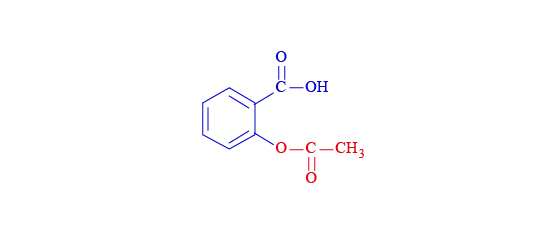
值得留意的是,羧基和酰基這兩個平面是互相垂直的,這是為了減低兩個官能基之間的排斥。
阿士匹靈是其中一種由天然有機物質,慢慢改進過來的醫藥用有機化合物,而這亦標誌著有機化學的水平日漸提升。時至今日,阿士匹靈仍是其中一種常用的藥物。
雖然阿士匹靈的結構簡單,但它不是科學家無中生有的創造,而是將自然界的物質逐步改進得來的成果。
透過以下影片,理解和欣賞科學家是如何從自然界獲得啟發,將柳樹樹皮漸漸發展成家喻戶曉的阿士匹靈。
我們在市面購買的阿士匹靈藥片,它們的純度多數不會是 \(100\%\)。
我們可憑「返滴定法」去測定一片阿士匹靈藥片的純度,具體步驟如下:
讓過量的已知濃度和體積的氫氧化鈉溶液與已知質量的阿士匹靈藥片反應,並同時加熱,阿士匹靈藥片中的乙酰水楊酸會被水解。
反應後,將剩餘的氫氧化鈉與已知濃度的酸溶液進行滴定,從而測定剩餘的氫氧化鈉的量。
最後,從剩餘的氫氧化鈉的量,計算阿士匹靈藥片中乙酰水楊酸的含量。
假設在剛才的步驟中,我們把 \(2.00\; \rm{g}\) 的阿士匹靈藥片放入一個三角燒瓶中,再把 \(25.0\; \rm{cm}^{3}\) 的 \(2.00\; \rm{mol}\; \rm{dm}^{−3}\) 氫氧化鈉溶液,並進行加熱,使阿士匹靈藥片中的乙酰水楊酸完全水解。當混合物冷卻後,再把它轉移至一個 \(250.0\; \rm{cm}^{3}\) 的容量瓶內,再加入蒸餾水,直至液面到達容器瓶的刻度。搖勻容量瓶內的溶液後,用移液管抽出 \(25.0\; \rm{cm}^{3}\) 的溶液,注入一個三角燒瓶,再加入酚酞指示劑,然後以 \(2.00\; \rm{mol}\; \rm{dm}^{−3}\) 氫氯酸進行滴定。到達滴定點時,共加入了 \(24.0\; \rm{cm}^{3}\) 的酸。
a) 計算滴定過程中消耗了多少摩爾的酸。
在 \(24.0\; \rm{cm}^{3}\) 的 \(2.00\; \rm{mol}\; \rm{dm}^{−3}\;\rm{HCl(aq)}\) 中,
\(\begin{align*}{\kern 12pt} \rm{HCl 的摩爾數} &= \rm{HCl 的濃度} \times \rm{HCl 的體積} \\ &= 2.00\;\rm{mol}\;\rm{dm}^{-3} \times \frac {24.0}{1000} \rm{dm}^{3} \\ &= 4.80 \times 10^{-2}\;\rm{mol} \end{align*}\)b) 計算滴定過程中,多少摩爾的氫氧化鈉與乙酰水楊酸產生水解反應。
在 \(25.0\; \rm{cm}^{3}\) 的 \(2.00\; \rm{mol}\; \rm{dm}^{−3}\; \rm{NaOH(aq)}\) 中,
\(\begin{align*}{\kern 12pt} \rm{NaOH 的摩爾數} &= \rm{NaOH 的濃度} \times \rm{NaOH 的體積} \\ &= 2.00\;\rm{mol}\;\rm{dm}^{-3} \times \frac {25.0}{1000} \rm{dm}^{3} \\ &= 0.0500\;\rm{mol} \end{align*}\)
\(\begin{align*} \rm{與乙酰水楊酸水解時消耗的 NaOH 的摩爾數} &= 0.0500\;\rm{mol} - 0.0480\;\rm{mol} \\ &= 2.00 \times 10^{-3}\;\rm{mol} \end{align*}\)
c) 計算有多少摩爾乙酰水楊酸被水解。
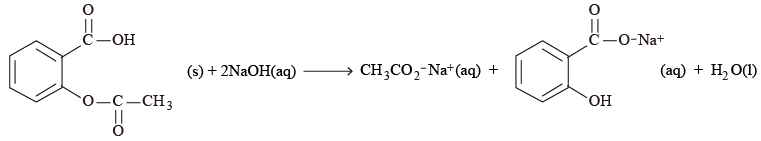
根據化學反應式, \(1\) 摩爾乙酰水楊酸與 \(2\) 摩爾氫氧化鈉水解。
\(\begin{align*} \rm{被水解的乙酰水楊酸的摩爾數} &= \frac {1}{2} \times 2.00 \times 10^{-3}\;\rm{mol} \\ &= 1.00 \times 10^{-3}\;\rm{mol} \end{align*}\)
d) 計算整瓶 \(250.0\; \rm{cm}^{3}\) 的溶液中,共有多少摩爾的乙酰水楊酸。
在 \(25.0\; \rm{cm}^{3}\) 的溶液中,乙酰水楊酸的摩爾數是 \(1.00 \times 10^{−3}\; \rm{mol}\)。
因此,
\(\begin{align*} {\kern 42pt} 250\;\rm{cm}^{3}\;\rm{的溶液中,乙酰水楊酸的摩爾數} &= 1.00 \times 10^{-3}\;\rm{mol} \times 10 \\ &= 1.00 \times 10^{-2}\;\rm{mol} \end{align*}\)
e) 計算阿士匹靈藥片中,乙酰水楊酸的產量百分比。
\(\begin{align*} \rm{乙酰水楊酸的產量百分比} &= \frac {\rm{乙酰水楊酸質量}}{\rm{藥片質量}} \times 100\% \\ &= \frac {\rm{乙酰水楊酸的摩爾數} \times \rm{乙酰水楊酸的摩爾質量}}{\rm{藥片質量}} \times 100\% \\ &= \frac {1.00 \times 10^{-2}\;\rm{mol} \times 180.0\;\rm{g}\;\rm{mol}^{-1}}{2.00\;\rm{g}} \times 100\% \\ &= 90.0\% \end{align*}\)