物質所處的狀態發生變化時,物質的焓是否會隨之改變呢?仔細觀察下面的三個互動,回答相應的問題並思考物質的焓與哪些條件有關。
從下面的三個動畫可以看出:物質的焓受到溫度、壓強(氣體)以及物質形態的影響。因此,爲了方便比較不同反應的焓變,化學家們制定出一套量度焓變的標準條件,即標準狀況。具體要求如下:
題解:
水被加熱時,水會從外界吸收熱量,從而轉化為體系的焓。所以,水的焓增加。
題解:
題解:
在相同條件下,物質可能存在不同的形態。例如:室溫下,會同時存在液態水以及水蒸汽。但是它們的能量(焓)是不同的。只有處在「標準態」下,才是物質的最穩定狀態。
物質的標準態是指在 \(25{{\ }^{\text{o}}}\text{C}\) 及 \(\text{1}\ \text{atm}\) 條件下,物質最穩定的狀態。
顧名思義,標準反應焓變是指在標準狀況下,反應物按照反應式所展示的係數進行反應時的焓變,其符號為 \(\Delta H_{\text{r}}^{\rlap{-} o}\)。
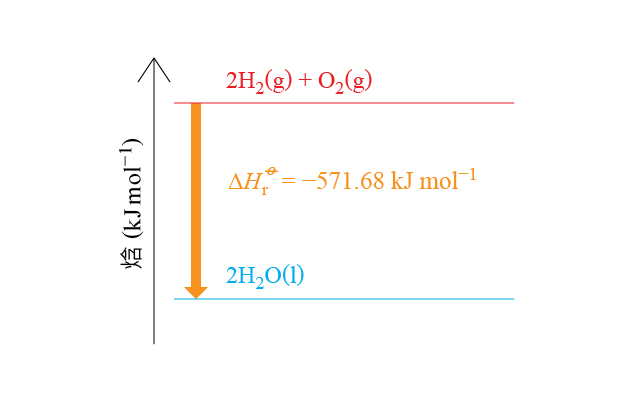
例如,在標準狀況下,\(\text{2}\ \text{mol}\) 氫氣和 \(\text{1}\ \text{mol}\) 氧氣反應生成 \(\text{2}\ \text{mol}\) 液態水時,放出 \(571.68\ \text{kJ}\) 的熱,可以用下面的熱化學反應式來描述這個過程:
\[\text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\ \text{+}\ {{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \to \ \text{2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\ \ \ \ \ \Delta H_{\text{r}}^{\rlap{-} o}\ =\ -571.68\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}}\]仔細觀察下面兩個反應式之間的差異,思考兩者的焓變有甚麽關係。
\[\begin{align} & \text{a}\text{.}\ \text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\ \text{+}\ {{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \to \ \text{2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\ \ \ \ \ \Delta H_{\text{r}}^{\rlap{-} o}\ =\ -571.68\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}} \\ & \text{b}\text{.}\ \text{4}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\ \text{+}\ \text{2}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \to \ \text{4}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\ \ \ \ \ \Delta H_{\text{r}}^{\rlap{-} o}\ =\ -1143.36\ \text{kJ}\ \text{mo}{{\text{l}}^{-1}} \\ \end{align}\]對比兩個反應式可以看出:反應式 \(\text{a}\) 中各物質的係數是反應式 \(\text{b}\) 中各物質係數的一半,其對應的標準反應焓變也是反應式 \(\text{b}\) 的一半。
也就是說,當展示化學反應過程的反應式不同時,其對應的標準反應焓變會隨著參與反應的物質的摩爾數的改變而相應改變。