焓(Enthalpy)是指物質的熱含量,其符號為 \(H\)。它是描述物質能量狀態的物理量,它的大小取決於該物質所處的狀態。
值得注意:一個物質的焓的絕對值是無法測定的。
焓變(Enthalpy Change)是指焓的變化,其符號為 \(\Delta H\)。如果體系的變化是在恆壓條件下進行的,那麼體系的焓變就是該體系的熱變化。
也就是說,對於恒壓下進行的化學反應,其焓變等於生成物的總焓與反應物總焓之差。即:
其中:\({{H}_{\text{p}}}\) 代表生成物的總焓;\({{H}_{\text{r}}}\) 代表反應物的總焓。
在右側,我們列舉了一些設計焓變的物理過程和化學過程,請同學點擊進入學習以便對焓變有更深入的了解。

在大氣壓強和室溫下,冰從外界吸收熱融化成水,體系的焓將增加。根據能量守恆定律,體系增加的焓等於其從外界吸收的熱,即:
\[\Delta H\ =\ {{Q}_{\text{吸}}}\]
請同學想一想:當你用手握住一塊冰時,你有甚麽感覺?你能解釋為甚麼會有這種感覺麼?
會有冰冷的感覺。這是因為冰的溫度低,會從手上吸收熱,而使手感覺到冰冷。
化學反應過程一般都會伴隨著焓變,這是因為每個物質都有特定的焓。反應物的焓和生成物的焓不同,就產生了焓差,也就是焓變。
下面列舉了一些常見的放熱反應和吸熱反應的過程。
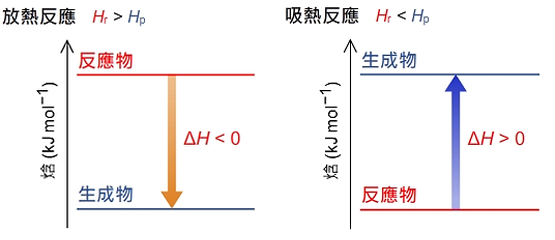
爲了更加直觀的展示反應過程的焓變,人們根據 \({{H}_{\text{p}}}\) 和 \({{H}_{\text{r}}}\) 的相對大小繪製出「焓級圖」來表示反應過程的焓變。
焓級圖是用來描述一個反應或者一連串反應的焓變的圖表。要正確繪製一個反應的焓級圖,就要明確以下兩點:
值得注意:由於物質的絕對焓值無法測定,所以焓級圖只能表示焓或焓變的相對大小。
在右側的互動中,介紹了如何繪製放熱反應和吸熱反應的焓級圖。請同學自行點擊查看以學習相關內容。
放熱反應過程中,體系向外界釋放熱,體系的焓降低,焓變為負。所以,在繪製焓級圖時,反應物位於生成物之上,表示體系的焓降低。
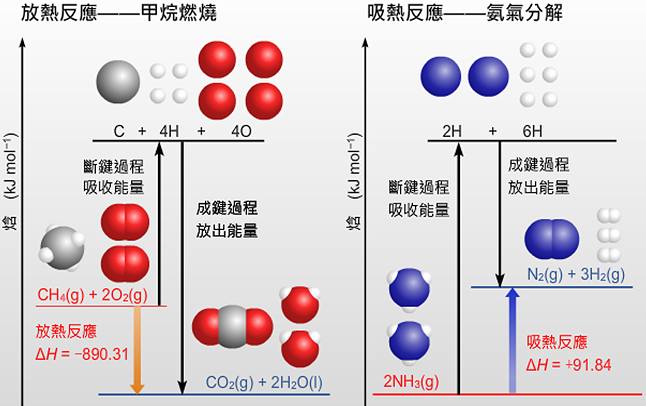
下面以甲烷燃燒為例,介紹如何繪製放熱反應的焓級圖。
\[\text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right)\ \text{+}\ \text{2}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \to \ \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \text{+}\ \text{2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\]
其中,\(1\ \text{mol}\) 甲烷燃燒時放出 \(\text{890}\text{.31}\ \text{kJ}\) 的熱。
吸熱反應過程中,體系從外界吸收熱,體系的焓升高,焓變為正。所以,在繪製焓級圖時,反應物位於生成物之下,表示體系的焓增加。
下面以三氧化硫分解為例,介紹如何書寫吸熱反應的焓級圖。
\[\text{2S}{{\text{O}}_{\text{3}}}\left( \text{g} \right)\ \to \ \text{2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \text{+}\ {{\text{O}}_{\text{2}}}\left( \text{g} \right)\]
其中,\(1\ \text{mol}\) 三氧化硫分解時,需要吸收 \(\text{197}\text{.78}\ \text{kJ}\) 的熱。
仔細觀察右側的焓級圖,思考如何利用焓級圖來解釋放熱反應或吸熱反應的本質?
用力才能分開兩塊極性不同的磁石;而極性不同的兩塊磁石會自動相互吸引黏在一起。
成鍵原子也是一樣。兩個極性不同的原子也會自發成鍵而結合在一起,並釋放出能量。相反,要斷裂已經成鍵的兩個原子則需要提供能量。
化學反應是生成新物質的過程。反應過程中必然涉及兩個過程:(1) 舊的化學鍵的斷裂;(2) 新的化學鍵的形成。
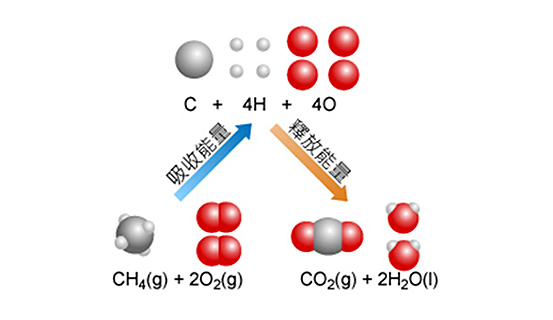
右側的動畫中,我們以甲烷燃燒過程為例,介紹化學反應過程中,化學鍵的斷裂和形成過程與能量的關係。
\[\text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right)\ \text{+}\ \text{2}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \to \ \text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\ \text{+}\ \text{2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\]
斷裂甲烷分子中的碳-氫鍵和氧中的氧=氧雙鍵,需要從外界吸收熱量,體系的焓會增加。
\[\text{C}{{\text{H}}_{\text{4}}}\ \to \ \text{C}\ \text{+}\ \text{4H}\] \[\text{2}{{\text{O}}_{\text{2}}}\ \to \ \text{4O}\]
形成的碳、氫和氧三種原子會相互結合生成二氧化碳和水。在形成碳=氧雙鍵和氫-氧鍵時,體系會釋放出熱,體系的焓會降低。
\[\text{C}\ \text{+}\ \text{2O}\ \to \ \text{C}{{\text{O}}_{\text{2}}}\] \[\text{4H}\ \text{+}\ \text{2O}\ \to \ \text{2}{{\text{H}}_{\text{2}}}\text{O}\]
化學反應過程的能量變化,實際就是斷裂舊的化學鍵與形成新的化學鍵之間的能量差值。如果化學反應是在恒壓條件下進行的,這個過程的熱變化就是反應的焓變。
\[\Delta H\ \text{=}\ {{Q}_{\text{放}}}\ -\ {{Q}_{\text{吸}}}\]
其中:\(\Delta H\) 代表化學反應過程的焓變;\({{Q}_{\text{放}}}\) 代表形成化學鍵時釋放的能量;\({{Q}_{\text{吸}}}\) 代表斷裂化學鍵時吸收的能量。
仔細觀察右側的焓級圖,思考如何利用焓級圖來解釋放熱反應或吸熱反應的本質?
甲烷燃燒過程中,斷裂甲烷和氧分子中的化學鍵
氨分解過程中,斷裂氨分子中的化學鍵
對比甲烷燃燒和氨分解過程的熱量變化可以看出: