體系是指在宇宙中我們所集中研究的某一特定範圍,這個範圍是有明確的邊界限制的。
外界則是指宇宙中所有在體系範圍之外的事物。
簡單來講:要研究甚麽,甚麽就是體系;除了體系以外的所有事物都是外界。
根據右側互動中的指引,將「體系」與「外界」的標籤拖放到畫面上適當的位置。
爲了研究無水硫酸銅(II) 溶解過程的熱變化,一名學生向裝有無水硫酸銅(II) 的試管中注入適量的水,並使之完全溶解。此時,用手觸摸試管外壁,就會發現試管壁發熱。根據描述判斷,以下哪項不屬於被研究的體系?
無水硫酸銅(II)
注入試管中的水
生成的硫酸銅(II) 溶液
握住試管的手
題解:
握住試管的手是感應反應過程中溫度變化的媒介,與化學反應過程無關,不屬於被研究的體系。
當我們要研究某一特定的化學反應時,這個化學反應就是體系。有兩種常見的化學反應體系:恒壓體系和恒體積體系。
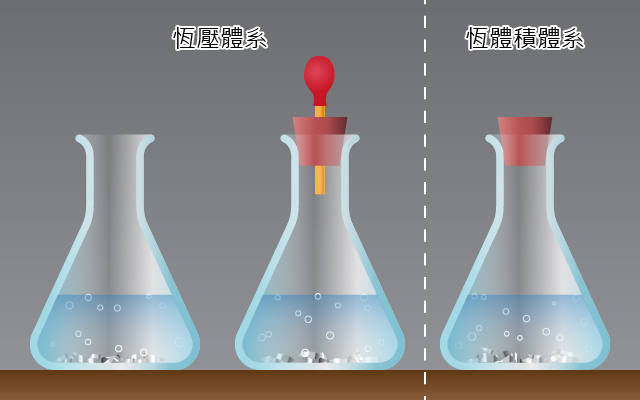
相同的化學反應,在恒壓體系或者恒體積體系中進行,會有甚麼不同呢?仔細觀察右側的動畫並回答下面的問題。
比較兩個反應體系,有哪些相同的之處?
產生氣體
溫度升高
放出熱
體積不變
題解:
兩個體系進行的化學反應是一樣的,所以涉及的化學變化本質是一樣的。但是,由於恆壓體系有氣球調節體系的壓強,所以恆壓體系在反應過程中,體積發生變化。
與恒體積體系相比,恆壓體系具有哪些特徵?
體系的溫度升幅較小
產生的氣體較多
放出的熱較少
體積保持不變
題解:
在恆壓體系中,產生的氣體會對外界作功,從而維持體系的壓強保持不變。所以,與恆體積體系相比,恆壓體系放出的熱較少,溫度升幅較小。由於反應的本質是一樣的,所以兩種體系中產生氣體的量相同。
能量守恆定律指出:能量不能被創造或是被毀滅,它只能由一種形式轉化為另一種形式,在轉化的過程中,能量的總和保持不變。
化學反應過程也是一樣。任何化學反應發生時,都伴隨著內部能量(內能)的變化。這種內能的變化,等於體系內能的起始值與最終值之差,即:
其中:\(\Delta E\) 是體系內能的變化;\({{E}_{\text{f}}}\) 是體系內能的最終值;\({{E}_{\text{i}}}\) 是體系內能的起始值。

根據能量守恆定律可知:化學反應過程中,體系向外界放出(吸收)的能量等於外界從體系吸收(放出)的能量。即:
其中:\(\Delta E\) 是體系內能的變化;\(Q\) 是體系放出或吸收的熱;\(W\) 是體系對外界或外界對體系所作的功。
可以看出:恆壓體系與恒體積體系的差別在於體系與外界之間是否作功。
所以,恆壓條件下,由於體系產生氣體,對外界作功,體系產生熱減少,溫度升幅較小。化學家們把恆壓下的熱變化,即 \(Q\left( \text{恆壓} \right)\) 定義為化學反應過程中的焓變。