在介紹能線圖之前,我們先來回顧一下碰撞理論的基本概念,以及發生化學反應的要求。仔細觀看右側的影片,選出發生化學反應的必須滿足的條件。
反應物的粒子以任意方向碰撞
反應物的粒子以正確的方向碰撞
反應物的粒子碰撞時,必須具有足夠的動能
反應物的粒子碰撞時,必須具有特定的動能
題解:
化學反應進行時,必然涉及能量的變化。如果將反應過程中勢能的變化繪製成圖,來表示一對碰撞分子的能量變化的途徑,就稱為反應的能線圖。
仔細觀看右側的影片,了解反應過程中物質和能量的變化,並完成下面的練習。
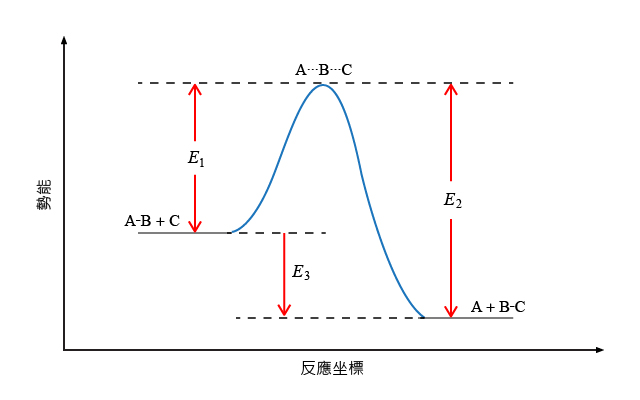
參照下列化學反應:
\[\text{A}-\text{B}\ \text{+}\ \text{C}\ \to \ \text{A}\ \text{+}\ \text{B}-\text{C}\]
根據右圖中所示的化學反應能線圖,以下哪些描述是正確的?
反應的活化能是 \({{E}_{\text{1}}}\)
反應的活化能是 \({{E}_{\text{2}}}\)
物種 \(\text{A}\cdots \text{B}\cdots \text{C}\) 是穩定的中間體
物種 \(\text{A}\cdots \text{B}\cdots \text{C}\) 分解時,不會形成反應物 \(\text{A}-\text{B}\) 和 \(\text{C}\)
反應的焓變是 \({{E}_{\text{3}}}\)
反應是放熱的
題解:
\(\text{A}\cdots \text{B}\cdots \text{C}\) 是舊的化學鍵已經斷裂而新的化學鍵尚未形成時的過渡態,是一個具有高能量的不穩定物種——稱為過渡態或活化複體。
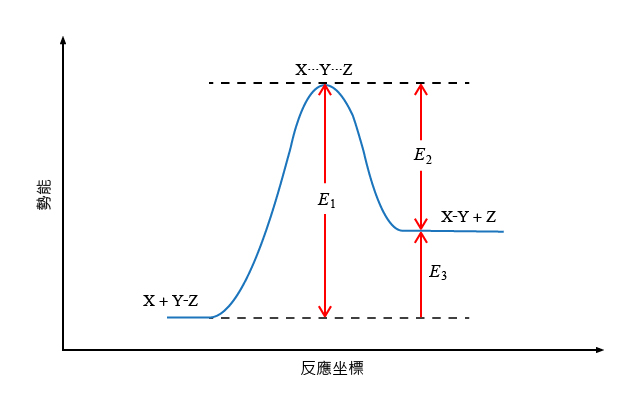
參照下列化學反應:
\[\text{X}\ \text{+}\ \text{Y}-\text{Z}\ \to \ \text{X}-\text{Y}\ \text{+}\ \text{Z}\]
根據右圖中所示的化學反應能線圖,以下哪些描述是正確的?
反應的活化能是 \({{E}_{\text{1}}}\)
反應的活化能是 \({{E}_{\text{2}}}\)
物種 \(\text{X}\cdots \text{Y}\cdots \text{Z}\) 是穩定的物種
物種 \(\text{X}\cdots \text{Y}\cdots \text{Z}\) 可以分解為 \(\text{X}\) 和 \(\text{Y}-\text{Z}\) 或 \(\text{X}-\text{Y}\) 和 \(\text{Z}\)
反應的焓變 \({{E}_{\text{3}}}\) 為正
反應是吸熱的
參照下列化學反應:
\[\text{A}-\text{B}\ \text{+}\ \text{C}\ \rightleftharpoons \ \text{A}\ \text{+}\ \text{B}-\text{C}\]
根據右圖中所示的化學反應能線圖,以下哪些描述是正確的?
題解:
通過可逆反應的能線圖,可以看出:
即:活化能越高,生成活性複體需要吸收的能量就越多,反應就越難發生。

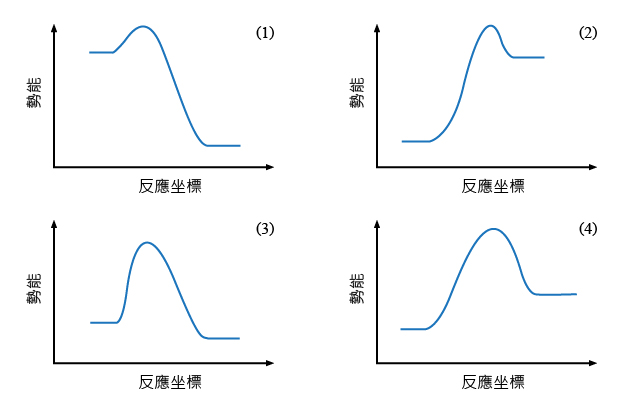
右圖為四幅等比例繪製的化學反應的能線圖。結合前面所學內容回答下面的問題。
題解:
由於能線圖可提供一個化學反應的活化能和焓變。所以,等比例繪製能線圖時,可比較反應過程中不同階段的能量變化。