此方法是利用澱粉與碘結合生成深藍色的複合體來顯示反應的進度,適用於涉及碘離子的氧化還原反應。
\[{{\text{I}}^{-}}\left( \text{aq} \right)\ \xrightarrow{\text{氧化劑}} {{\text{I}}_{\text{2}}}\left( \text{aq} \right)\]
右側的影片中,展示了以過氧化氫為氧化劑時,利用碘時鐘法來測定反應級數的實驗。其中涉及的化學反應包括:
通過上面的影片可以看出:在反應過程中,溶液的顏色會突然變成深藍色。我們假設:溶液轉變為深藍色時,溶液中的硫代硫酸根離子剛好被耗盡。這是因為,硫代硫酸根離子(\({{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}^{\text{2}-}\left( \text{aq} \right)\))被耗盡之後,生成的碘就不會轉化為碘離子,而使澱粉變為深藍色。
在實驗過程中,我們可以量度反應物起始濃度不同時,溶液轉變為藍色所需的時間,從而獲得反應物的起始濃度與反應初速率的關係曲線。
若要獲得碘離子(過氧化氫)的反應級數 ,實驗中就必須維持以下條件不變:
即:在測定某一物質的反應級數時,必須確保其它物質的濃度和其它反應條件保持不變。
一名同學利用碘時鐘法進行實驗,來測定硫酸的反應級數。實驗中,井穴條 \(\text{A}\) 中四個孔(編號為 \({{\text{A}}_{\text{1}}}-{{\text{A}}_{\text{4}}}\))內的溶液完全相同,包括碘離子(\(\text{0}\text{.60}\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\),\(1\) 滴)、硫代硫酸根離子(\(\text{0}\text{.08}\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\),\(1\) 滴)以及澱粉溶液(\(1\) 滴)。而井穴條 \(\text{B}\) 中的溶液為過氧化氫(\(1.5\ \%\))、水以及稀硫酸(\(\text{0}\text{.60}\ \text{mol}\ \text{d}{{\text{m}}^{-3}}\))的混合物。其具體資料及實驗數據如下表所示。
| 井穴條孔號 | 井穴條孔號 | 滴數 | 溶液變藍所需的時間 \(t\) \(\left( \text{s} \right)\) | ||
|---|---|---|---|---|---|
| \({{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}\left( \text{aq} \right)\) | \({{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\) | \({{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\left( \text{aq} \right)\) | |||
| \({{\text{A}}_{\text{1}}}\) | \({{\text{B}}_{\text{1}}}\) | \(1\) | \(7\) | \(1\) | \(61\) |
| \({{\text{A}}_{\text{2}}}\) | \({{\text{B}}_{\text{2}}}\) | \(1\) | \(6\) | \(2\) | \(44\) |
| \({{\text{A}}_{\text{3}}}\) | \({{\text{B}}_{\text{3}}}\) | \(1\) | \(4\) | \(4\) | \(22\) |
| \({{\text{A}}_{\text{4}}}\) | \({{\text{B}}_{\text{4}}}\) | \(1\) | \(0\) | \(6\) | \(12\) |
根據上表中的數據,分別計算硫酸的相對濃度和時間的倒數,並繪製兩者的關係曲線,找出硫酸的反應級數。
| 井穴條孔號 | 硫酸的相對濃度 | 溶液變藍所需的時間 \(t\) \(\left( \text{s} \right)\) | 相對速率 \(\displaystyle{ \frac{1}{t}\left( {{\text{s}}^{-1}} \right) }\) |
|---|---|---|---|
| \(1\) | \(1\) | \(61\) | \(0.016\) |
| \(2\) | \(2\) | \(44\) | \(0.023\) |
| \(3\) | \(4\) | \(22\) | \(0.045\) |
| \(4\) | \(6\) | \(12\) | \(0.083\) |
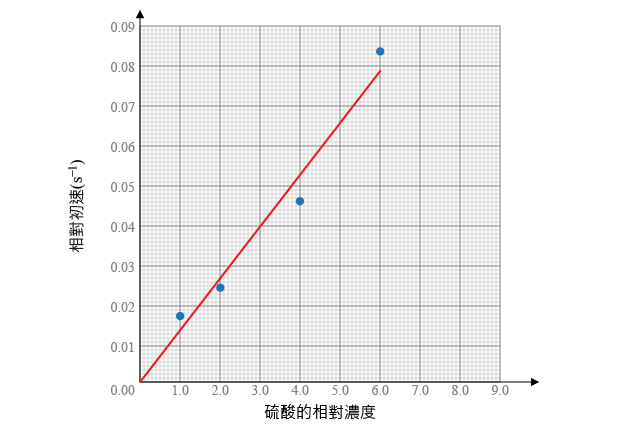
由坐標圖可知,硫酸的相對濃度與初速率成正比,即:
\[\text{速率}\propto \left[ {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{4}}\left( \text{aq} \right) \right]\ \text{或者}\ \text{速率}\ = k\left[ {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{4}}\left( \text{aq} \right) \right]\]
所以,反應過程中,硫酸的反應級數為 \(1\)。
測量原理:溶液變藍所需的時間,與此時間內的平均速率成反比。
由於溶液變藍所需的時間較短,物質濃度的變化較小,我們假設溶液中,主反應涉及的各物質的濃度維持不變,並用相對平均速率表示相對初速率。即:
此時,時間的倒數就可用來代替相對初速率。
\[\displaystyle{ \text{初速}∝\frac{1}{\text{溶液變藍所需的時間}} }\]