此方法的適用性最廣,主要是通過改變反應物的起始濃度,量度初始速率的變化,繪製初速率對反應物起始濃度的曲線,從而找出該反應物的反應級數。
例如,過氧化氫在過氧化氫酶的催化作用下,可以迅速分解,生成水並釋出氧。
\[\text{2}{{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}\left( \text{aq} \right)\ \xrightarrow{\text{過氧化氫酶}} \text{2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\ \text{+}\ {{\text{O}}_{\text{2}}}\left( \text{g} \right)\]
右側的動畫中,展示了實驗裝置及操作過程。請同學們點擊觀看。
以過氧化氫分解為例:反應過程中,會產生氣體氧。由於氧不溶於水,我們可以利用排水法來量度反應過程中生成氧的體積,從而繪製時間對氧的體積的坐標圖。而在 \(0\) 秒時,曲線的斜率,即為該條件下,過氧化氫分解的初速率。我們假設:生成的氧的體積,等於排出的水的體積。
要獲得過氧化氫分解的反應級數,我們可以量度不同起始濃度的過氧化氫分解時的初速率,然後繪製過氧化氫的濃度與初速率的關係曲線。根據曲線的趨勢,判斷反應級數。
若要獲得過氧化氫的反應級數 ,實驗中就必須維持以下條件不變:
即:在測定某一物質的反應級數時,必須確保其它物質的濃度和其它反應條件保持不變。
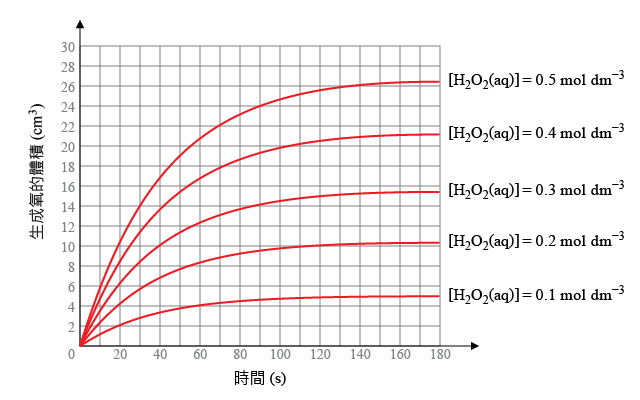
一名同學利用此方法進行實驗,來測定過氧化氫的反應級數。根據實驗結果,繪製過氧化氫起始濃度不同時,時間對生成氧的體積坐標圖(如右圖所示)。
根據右圖,計算過氧化氫起始濃度對應的初速率,並繪製過氧化氫的起始濃度對生成氧的初速率的坐標圖,判斷過氧化氫的反應級數。
| 過氧化氫的起始濃度 \(\left( \text{mol}\ \text{d}{{\text{m}}^{-3}} \right)\) | 生成氧的初速率 \(\left( \text{c}{{\text{m}}^{3}}\ {{\text{s}}^{-1}} \right)\) |
|---|---|
| \(0.50\) | \(0.64\) |
| \(0.40\) | \(0.52\) |
| \(0.30\) | \(0.39\) |
| \(0.20\) | \(0.26\) |
| \(0.10\) | \(0.13\) |
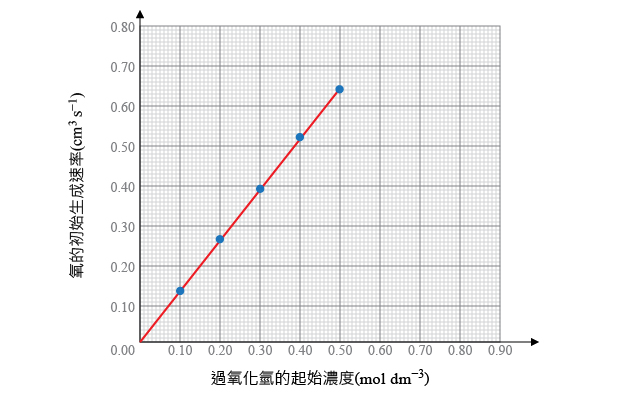
由坐標圖可知,過氧化氫的起始濃度與生成氧的初速率成正比,即:
\[\text{速率}\propto \left[ {{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}\left( \text{aq} \right) \right]\ \text{或者}\ \text{速率}=k\left[ {{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}\left( \text{aq} \right) \right]\]
所以,反應過程中,過氧化氫的反應級數為 \(1\)。