週期表是一個有系統的排列元素的方式。元素在週期表中的位置,是由它的原子序和電子排佈決定的。
在週期表中,各元素符號的左上方標示的是該元素的原子序 (如所示)。
在元素週期表中,所有元素都是按原子序從小到大的順序排列的。
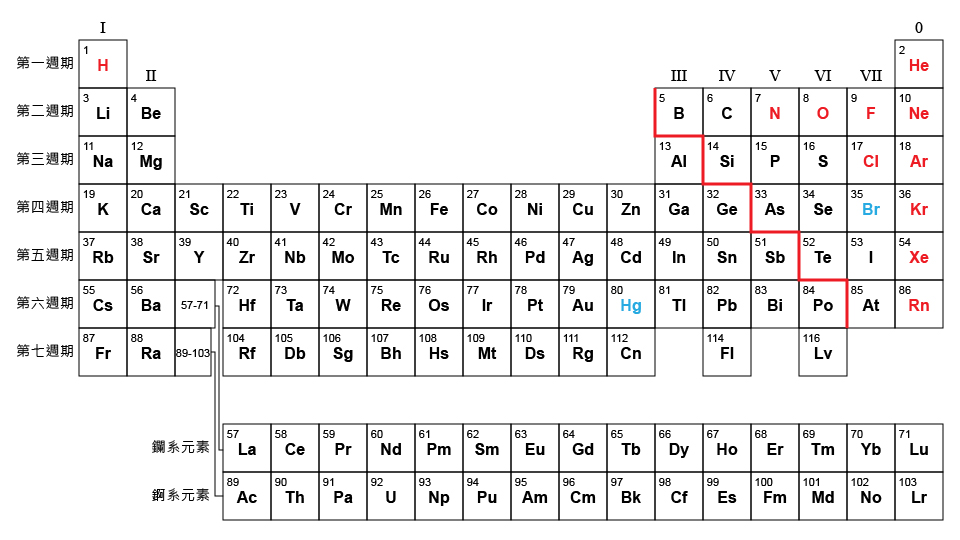
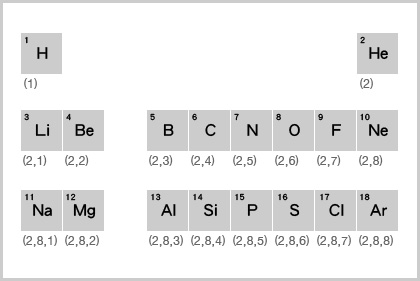
元素的週期數等於其原子內被電子佔用的電子層數目。
例如,通過比較第一、二和三週期元素的原子的電子排佈,可以看出:第一週期的元素的原子有 \(1\) 個被電子佔用的電子層;第二週期的元素的原子有 \(2\) 個被電子佔用的電子層;第三週期的元素的原子有 \(3\) 個被電子佔用的電子層。

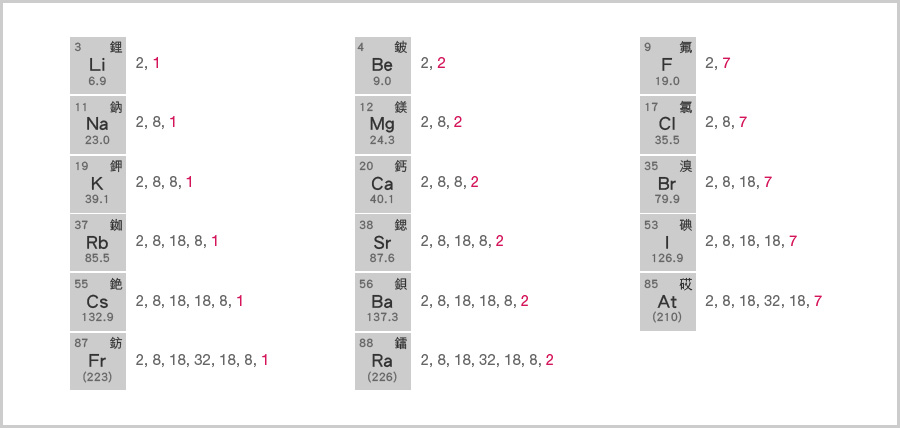
除第 \(0\) 族和氫外,元素的族數等於其原子的最外層電子數目。
例如,通過比較第 \(\text{I}\)、\(\text{II}\) 和 \(\text{VII}\) 族原子的電子排佈,可以看出:第 \(\text{I}\) 族的原子只有 \(1\) 個最外層電子;第 \(\text{II}\) 族的原子有 \(2\) 個最外層電子;第 \(\text{VII}\) 族的原子有 \(7\) 個最外層電子。
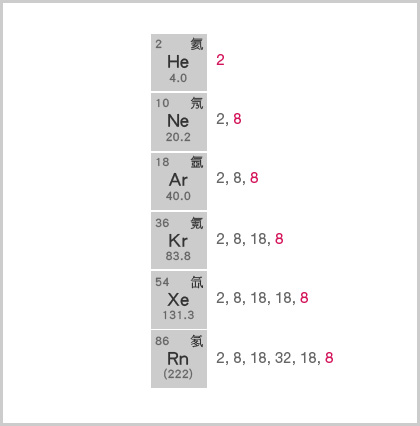
但是,第 0 族貴氣體和氫是兩個特例。
特例一:第 0 族貴氣體
貴氣體原子的最外層電子數目不盡相同:氦 (\(\ce{He}\)) 原子只有 \(2\) 個最外層電子,而其他貴氣體原子都有 \(8\) 個最外層電子。這是由於第 \(n\) 電子層最多能容納的電子數目為 \(2n^2\),而氦只有一個被電子佔據的電子層,因此,該層最多能容納的電子數目 \(= 2 \times 1^2 = 2\) 個。
特例二:氫
因為氫原子只有一個最外層電子,所以,氫位於在週期表的第一縱行。但是,第 I 族鹼金屬並不包括氫。這是因為氫是非金屬,其性質與鹼金屬完全不同。因此,氫不屬於任何一族。