關於原子的內部結構,科學家提出了很多不同的假設。其中,最著名的模型之一,是由丹麥的物理學家 Niels Bohr 最早提出的「波爾模型」 (Bohr Model)。
在波爾模型中,電子在固定的軌道上圍繞原子核運行,就像行星圍繞著太陽一樣。Bohr 將電子運行的軌道稱為「電子層」 (electronic shell),按距離原子核由近至遠,分別標記為 \(1\),\(2\),\(3\),\(4\) …。
事實上,電子繞核運行的方式並不是如同 Bohr 假設的那樣,但是,波爾模型能夠很好地解釋原子和週期表,對原子物理學產生了深遠的影響。Niels Bohr 亦因為對科學的巨大貢獻而獲得 \(1922\) 年的諾貝爾物理學獎。
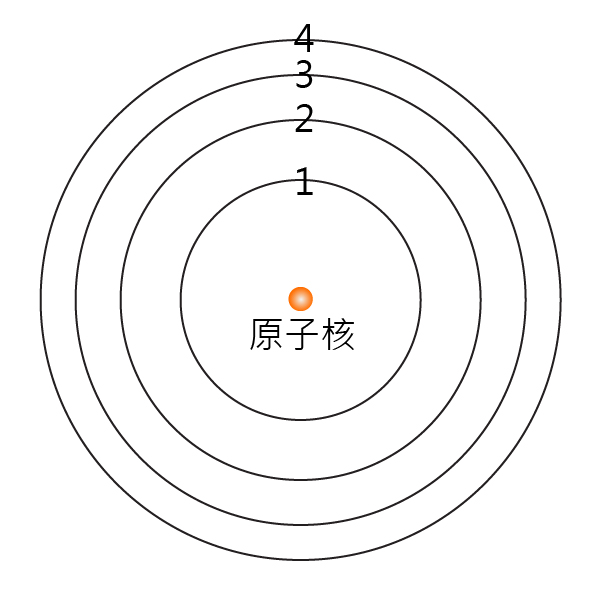
電子在各電子層的排列方式,稱為「電子排佈」 (electronic arrangement)。
電子排佈遵循以下規則:
每個電子層最多能容納的電子數目是有限的。第 \(n (n≥1)\) 電子層上能容納電子的最大數目 \(= 2n^2\)。
電子總是從最靠近原子核的電子層開始填充,當第一層被填滿後,剩餘的電子才會填入下一層,如此類推,直至所有電子都已填入為止。
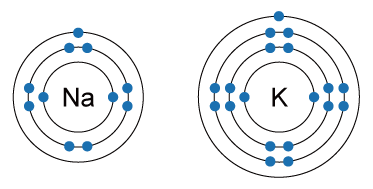
例如,鈉原子有 \(11\) 個電子,它們首先填入第一層;第一層最多只能容納 \(2\) 個電子,剩餘的電子繼續填入第二層;第二層最多只能容納 \(8\) 個電子,最終剩餘的 \(1\) 個電子填入第三層。
| 電子層 \((n)\) | 該層最多能容納的電子數目 |
|---|---|
| \(1\) | \(2\) |
| \(2\) | \(8\) |
| \(3\) | \(18\) |
| \(4\) | \(32\) |
若第 \(n (n>2)\) 電子層是最外電子層,則該電子層能容納的電子數目不能超過 \(8\)。
例如,鉀原子有 \(19\) 個電子,若只根據前面兩個規則,那麼,它的第三電子層應填入 \(9\) 個電子。但是,由於最外電子層的電子數目不能超過 \(8\) ,因此,鉀的第三電子層只填入 \(8\) 個電子,而最後剩餘的 \(1\) 個電子填入第四電子層。