觀察元素的原子半徑,嘗試回答下列問題。
比較第二週期各元素的原子半徑,由左至右,呈現怎樣的週期性變化?第三週期呢?
比較第 \(\text{I}\) 族各元素的原子半徑,由上至下,呈現怎樣的週期性變化?第 \(\text{VII}\) 族呢?
你能夠解釋為甚麼元素的原子半徑會呈現這樣的週期性變化麼?
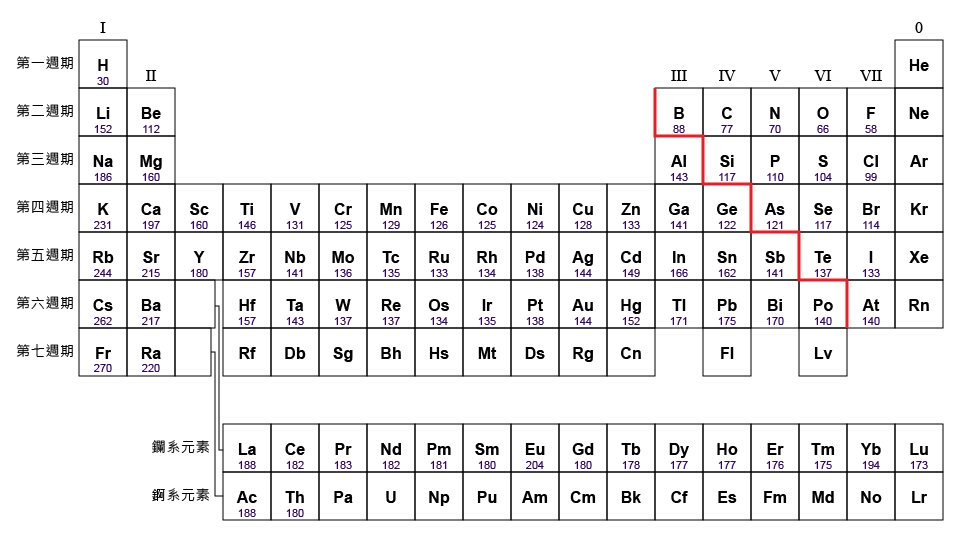
通過比較第二週期和第三週期元素的原子半徑,我們會發現:在同一週期內,原子半徑由左至右逐漸減小。
引致原子半徑呈現這樣的週期性變化的主要原因是,原子核與外層電子之間不斷增加的吸引力。
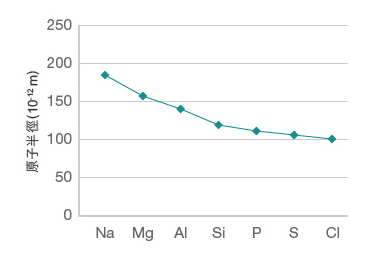
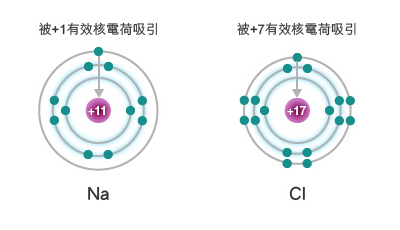
以第三週期為例,原子的有效核電荷由左至右逐漸增大。
鈉的有效核電荷 \(= +11 − 10 = +1\),
鎂的有效核電荷 \(= +12 − 10 = +2\),
鋁的有效核電荷 \(= +13 − 10 = +3\),
硅的有效核電荷 \(= +14 − 10 = +4\),
磷的有效核電荷 \(= +15 − 10 = +5\),
硫的有效核電荷 \(= +16 − 10 = +6\),
氯的有效核電荷 \(= +17 − 10 = +7\)。
因此,雖然第三週期元素的原子均具有三個電子層,其最外層電子均位於第三電子層上,但是,隨著有效核電荷由左至右逐漸增大,原子核與外層電子之間的吸引力不斷增大,這使得外層電子被拉至距離原子核更近的位置,導致第三週期元素的原子半徑由左至右逐漸減小。
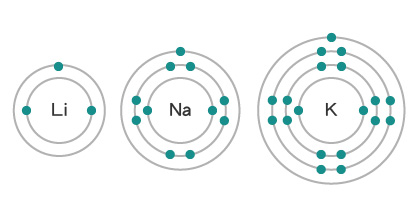
通過比較第 \(\text{I}\) 族和第 \(\text{VII}\) 族元素的原子半徑,我們會發現:在同一族內,原子半徑由上至下逐漸增大。
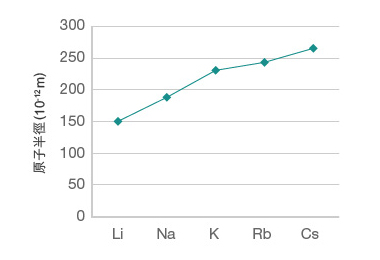

借助原子的波爾模型,很容易解釋這種變化產生的原因。在同一主族內,原子內被電子佔用的電子層數目由上至下依次增加,令原子半徑不斷增大。以第 \(\text{I}\) 族為例,\(\ce{Li}\) 有兩個電子層,\(\ce{Na}\) 有三個電子層,而 \(\ce{K}\) 有四個電子層,因此,\(\ce{Li}\) 的原子半徑 \(<\) \(\ce{Na}\) 的原子半徑 \(<\) \(\ce{K}\) 的原子半徑 。