質譜是一個相對強度 (relative intensity) 對質荷比 (即離子的質量與所帶電荷數的比值,\(m/z\)) 的圖表。由於在離子化過程中所生成的陽離子絕大多數都帶一個正電荷,因此,一般而言,質譜中離子的質荷比等於它的相對質量。下面我們將分別介紹元素和化合物的質譜的基本特徵,和從中可獲得的重要信息。
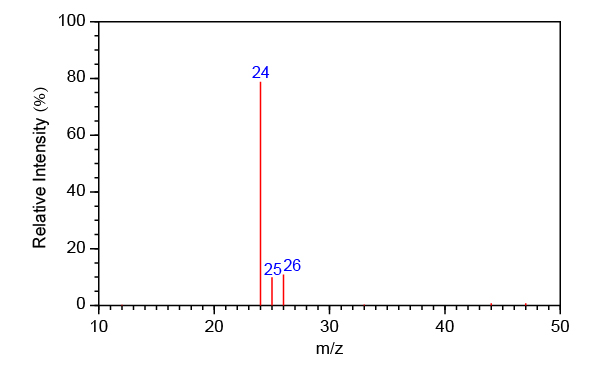
在元素的質譜中,不同的峰源自不同的同位素。峰的質荷比即是該同位素的相對質量,而峰的相對強度表示的是該同位素的相對豐度。因此,由元素的質譜,我們可以很容易地找出該元素的各種同位素的相對質量和相對豐度。這些是計算元素的相對原子質量所必需的信息。
以鎂的質譜為例,由質荷比可知,鎂有三種同位素,它們的相對質量分別是 \(24\)、\(25\) 和 \(26\);由相對強度可知,\(\ce{^24Mg}\)、\(\ce{^25Mg}\) 和 \(\ce{^26Mg}\) 的相對豐度分別是 \(78.9\%\)、\(10.0\%\) 和 \(11.1\%\)。
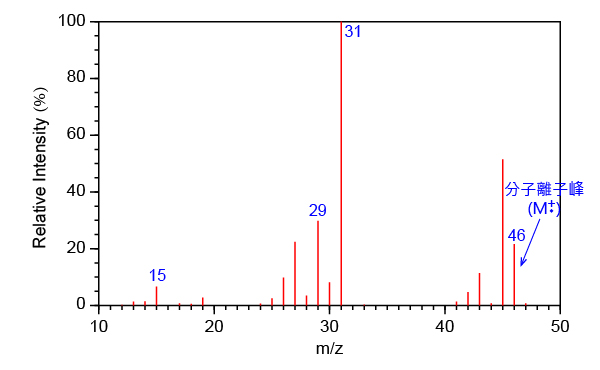
一般而言,化合物的質譜中質荷比最高的峰來自分子離子。分子離子 \(\ce{(M^{$\underset{\bullet}{\scriptsize{+}}$})}\) 是分子 \(\ce{(M)}\) 被高能量電子撞擊而失去一個電子所形成的。
\[\ce{M(g) + e^- -> M^{\underset{\bullet}{\scriptsize{+}}} (g) + 2e^{\scriptsize{-}}}\]例如,乙醇的相對分子質量是 \(46\)。在乙醇的質譜中,質荷比為 \(46\) 的峰正是源自分子離子 \(\ce{[CH3CH2OH]^{$\underset{\bullet}{\scriptsize{+}}$}}\),它是所有質譜峰中質荷比最高的。源自分子離子的質譜峰,稱為分子離子峰 (molecular ion peak)。因此,由分子離子峰,我們可以找出化合物的相對分子質量。
請注意,有些情況下,質荷比最高的峰並不是分子離子峰。例如,有些分子離子很容易發生碎裂,難以被質譜儀檢測到。另外,在 \((\text{M}+1)^{\underset{\bullet}{\scriptsize{+}}}\) 和 \((\text{M}+2)^{\underset{\bullet}{\scriptsize{+}}}\) 處有時會出現同位素離子峰,它們是源自較重的同位素所構成的分子離子。
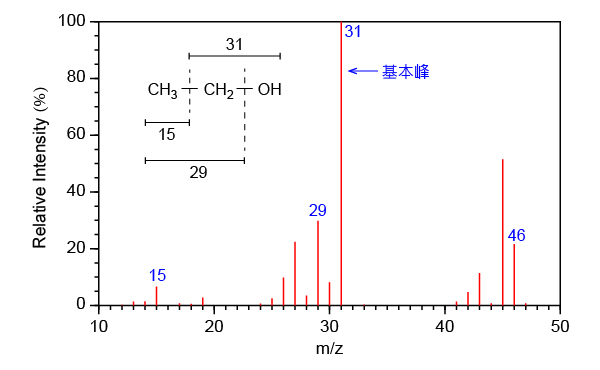
分子離子會因高能量電子的撞擊而繼續發生碎裂,生成更細小的離子。源自這些離子的峰,亦會出現在質譜上。例如,乙醇的分子離子在被撞擊後,會生成 \(\ce{CH2OH^{\small{+}}}\)、\(\ce{CH3CH2^{\small{+}}}\) 和 \(\ce{CH3^{\small{+}}}\)。所對應的碎裂模式如下:
\[\begin{align} & \nearrow \;\;\;\; \ce{\underset{\large{m/z \;=\; 29} \\ \;}{CH3CH2^{\small{+}}} \; + \; .OH} \\ \ce{[CH3CH2OH]^{$\underset{\bullet}{\scriptsize{+}}$}}\;\; & \ce{->} \;\; \ce{\underset{\large{m/z \;=\; 31} \\ \;}{CH2OH^{\small{+}}} \; + \; .CH3 } \\ & \searrow \;\;\;\; \ce{\underset{\large{m/z \;=\; 15}}{CH3^{\small{+}}} \; + \; .CH2OH } \\ \end{align}\]從中可以看出,分子離子的碎裂模式與分子的結構有關,也就是說,由碎裂模式,我們可以推斷化合物的分子結構。
由於這些陽離子的穩定性不同,因此它們所產生的訊號強度亦不同。最穩定的陽離子所產生的檢測訊號最強。這個峰,稱為基本峰 (basic peak),它的強度被定為 \(100\%\),而其他峰的強度則是以基本峰的強度為基準所得出的相對值。例如,乙醇質譜中的基本峰是質荷比為 \(31\) 的峰,它源自 \(\ce{CH2OH^{\small{+}}}\)。