氯、氨、氯化氫和二氧化硫是有氣味或 (和) 有顏色的氣體,它們的試驗方法如下:
氯 \(\ce{(Cl2)} \) 是黃綠色有刺激性氣味的氣體。
用濕潤的藍色石蕊試紙進行試驗,若試紙先變紅,後被漂白,則說明該氣體是氯。
氯是一種酸性氣體,能與水反應,生成氫氯酸和次氯酸,酸能令濕潤的藍色石蕊試紙變紅。由於次氯酸根離子 \(\ce{(ClO^- (aq))} \) 具有漂白作用,能令染料變成無色,因此,石蕊試紙隨即被漂白。
\[\ce{Cl2 (g) + H2O (l) <=> HCl (aq) + HOCl (aq) }\]
氨 \(\ce{(NH3)} \) 是無色有刺激性氣味的氣體。
用濕潤的紅色石蕊試紙進行試驗,若試紙變藍,則說明該氣體可能是氨。
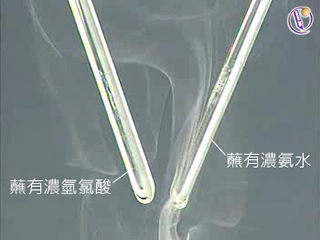
將蘸有濃氫氯酸的玻璃棒伸入裝有氣體的試管中,若觀察到大量濃煙生成,說明該氣體是氨。
氨是一種鹼性氣體,溶於水後形成氨水。氨水呈鹼性,能令濕潤的紅色石蕊試紙變藍。
濃氫氯酸是較高濃度的氯化氫的水溶液,具有揮發性。當氨和氯化氫相遇,會反應生成白色固體——氯化銨,因此,會觀察到白色濃煙 (即氯化銨固體小顆粒懸浮於空氣中)。
\[\ce{NH3 (g) + HCl (g) -> NH4Cl (s) }\]

氯化氫 \(\ce{(HCl)} \) 是無色有刺激性氣味的氣體。氯化氫是一種酸性氣體,溶於水後,可形成氫氯酸,因此,氯化氫能令濕潤的藍色石蕊試紙變紅。
將蘸有濃氨水的玻璃棒伸入裝有氣體的試管中,若觀察到大量濃煙生成,說明該氣體是氯化氫。
用蘸有濃氨水的玻璃棒試驗氫氯酸的原理,與用蘸有濃氫氯酸的玻璃棒試驗氨的原理相同,均是因為氨和氯化氫反應,生成白色固體——氯化銨。
\[\ce{NH3 (g) + HCl (g) -> NH4Cl (s) }\]
二氧化硫 \(\ce{(SO2)} \) 是無色有獨特的燒硫氣味的氣體。二氧化硫是一種酸性氣體,溶於水後,可形成亞硫酸,因此,二氧化硫能令濕潤的藍色石蕊試紙變紅。
用酸化重鉻酸鉀溶液試驗,若溶液由橙色變為綠色,則說明該氣體是二氧化硫。
在酸性條件下,二氧化硫能將重鉻酸根離子 \(\ce{(Cr2O7^2- (aq))} \) 還原成鉻(III)離子 \(\ce{(Cr^3+ (aq))} \)。由於 \(\ce{Cr2O7^2- (aq)} \) 是橙色的,而 \(\ce{Cr^3+ (aq)} \) 是綠色的,因此,會觀察到溶液由橙色變為綠色。
\[\ce{\underset{\large{橙色}}{Cr2O7^2- (aq)} + 3SO2 (g) + 2H^+ (aq) -> \underset{\large{綠色}}{2Cr^3+ (aq)} + 3SO4^2- (aq) + H2O(l) }\]