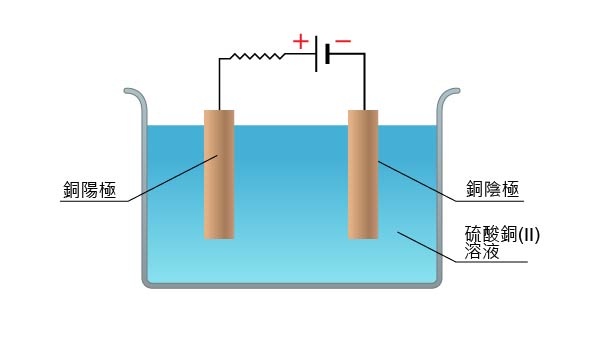
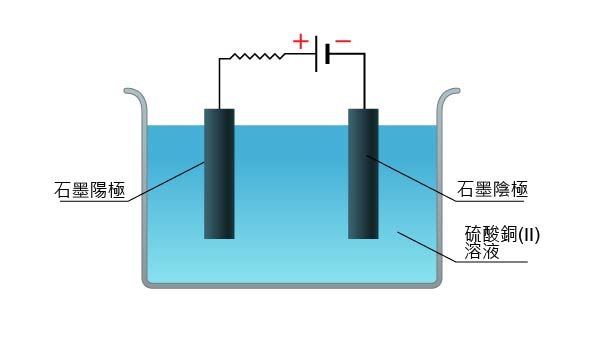
電極的性質亦可能影響離子的放電次序。下面我們將比較用石墨電極和銅電極電解硫酸銅(II)溶液的反應。
由於硫酸銅(II)的離解和水的微弱電離,在硫酸銅(II)溶液中存在四種離子:\(\ce{Cu^2+ (aq)} \)、\(\ce{H^+ (aq)} \)、\(\ce{SO4^2- (aq)} \) 和 \(\ce{OH^- (aq)} \)。用石墨電極電解硫酸銅(II)溶液時,
陽極: 有無色氣體生成。這是因為 \(\ce{OH^- (aq)} \) 在電化序中的位置遠高於 \(\ce{SO4^2- (aq)} \),更容易失去電子,因此,\(\ce{OH^- (aq)} \) 優先放電,生成氧。
\[\ce{4OH^- (aq) -> O2(g) + 2H2O(l) + 4e^-} \]陰極:有紅棕色固體生成。這是因為 \(\ce{Cu^2+ (aq)} \) 在電化序中的位置低於 \(\ce{H^+ (aq)} \),更容易獲得電子,因此, \(\ce{Cu^2+ (aq)} \) 優先放電,生成銅。
\[\ce{Cu^2+ (aq) + 2e^- -> Cu(s)} \]溶液的變化:從總反應式可以看出,由於銅(II)離子和氫氧離子因放電而減少,溶液的顏色逐漸消退,酸性逐漸增強,最終變為無色的硫酸溶液。
用銅電極電解硫酸銅(II)溶液時,
陽極:銅陽極溶解。這是因為 \(\ce{Cu(s)} \) 在電化序中的位置高於 \(\ce{OH^- (aq)} \) 和 \(\ce{SO4^2- (aq)} \),更容易失去電子,因此,\(\ce{Cu(s)} \) 陽極本身發生氧化反應,生成銅(II)離子。
\[\ce{Cu(s) -> Cu^2+ (aq) + 2e^-} \]陰極:有紅棕色固體 (銅) 生成。這是因為 \(\ce{Cu^2+ (aq)} \) 在電化序中的位置低於 \(\ce{H^+ (aq)} \),更容易獲得電子,因此,\(\ce{Cu^2+ (aq)} \) 優先放電,生成銅。
\[\ce{Cu^2+ (aq) + 2e^- -> Cu(s)} \]總反應:合併陰極反應和陽極反應,可得到總反應式。 \[\ce{Cu(s) + Cu^2+ (aq) -> Cu^2+ (aq) + Cu(s)} \]
溶液的變化:從總反應式可以看出,每當一個 \(\ce{Cu^2+ (aq)} \) 在陰極放電而被消耗時,便有一個 \(\ce{Cu^2+ (aq)} \) 在陽極生成,所以,硫酸銅(II)溶液的濃度和顏色均保持不變。