由於氯化鈉的離解和水的微弱電離,
\[ \begin{align*} \ce{ NaCl(aq) &-> Na^+ (aq) + Cl^- (aq) \\ H2O(l) &<=> H^+ (aq) + OH^- (aq) } \end{align*} \]在氯化鈉溶液中存在四種離子:\(\ce{Na^+ (aq)} \)、\(\ce{H^+ (aq)} \)、\(\ce{Cl^- (aq)} \) 和 \(\ce{OH^- (aq)} \)。
若只考慮離子在電化序中的位置對離子放電次序的影響,在電解氯化鈉溶液的過程中,應是 \(\ce{OH^- (aq)} \) 和 \(\ce{H^+ (aq)} \) 分別在陽極和陰極上優先放電,生成氧和氫。而事實上是不是這樣呢?有沒有其他因素亦會影響到離子的優先放電次序呢?
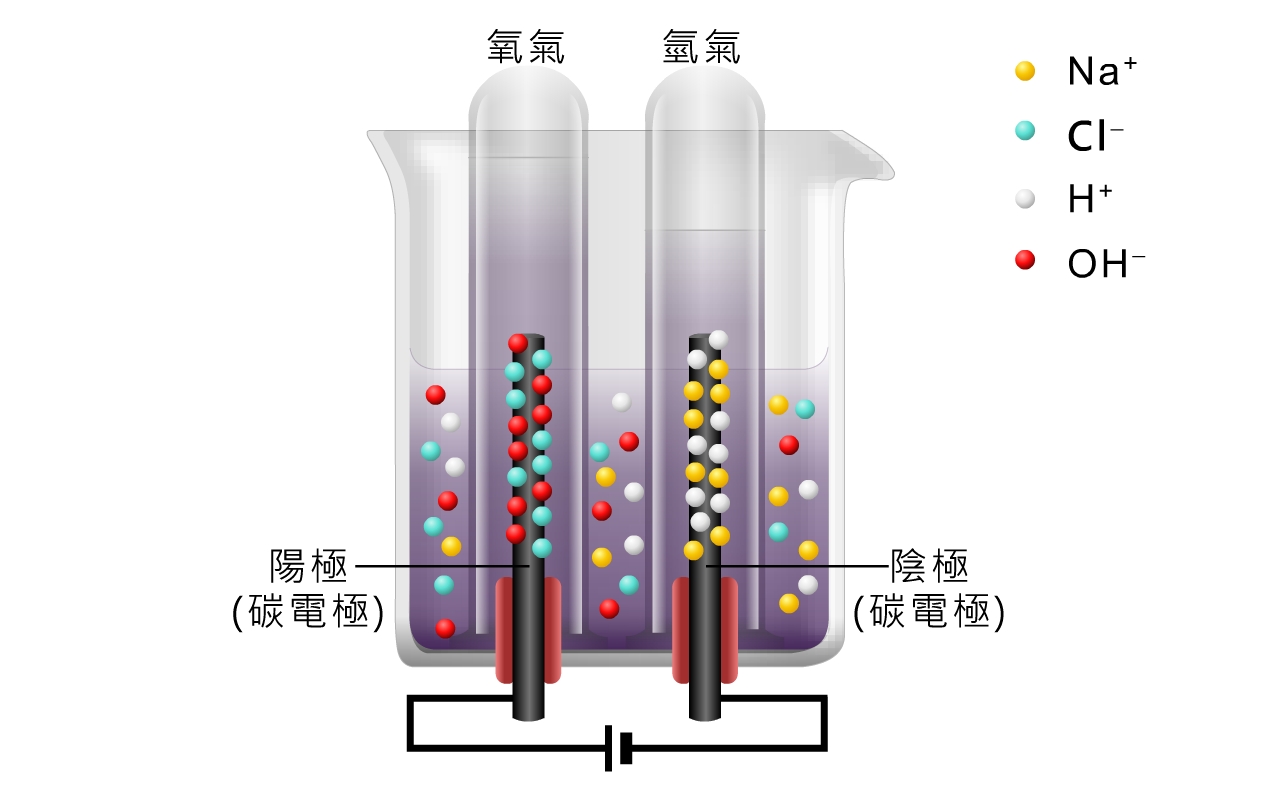
在使用石墨電極電解極稀氯化鈉溶液時,發生的電解反應與電解稀硫酸的類似。
陽極反應:\(\ce{OH^- (aq)} \) 優先放電,生成氧。這是因為 \(\ce{OH^- (aq)} \) 在電化序中的位置比 \(\ce{Cl^- (aq)} \) 高,更容易失去電子。
\[\ce{4OH^- (aq) -> O2(g) + 2H2O(l) + 4e^-} \]陰極反應:\(\ce{H^+ (aq)} \) 優先放電,生成氫。這是因為 \(\ce{H^+ (aq)} \) 在電化序中的位置比 \(\ce{Na^+ (aq)} \) 低,更容易獲得電子。
\[\ce{2H^+ (aq) + 2e^- -> H2(g)} \]溶液的變化:由於水不斷地被電解,因此氯化鈉的濃度逐漸增大。
電解極稀氯化鈉溶液,實際上是電解水,氯化鈉起到提高導電性的作用。
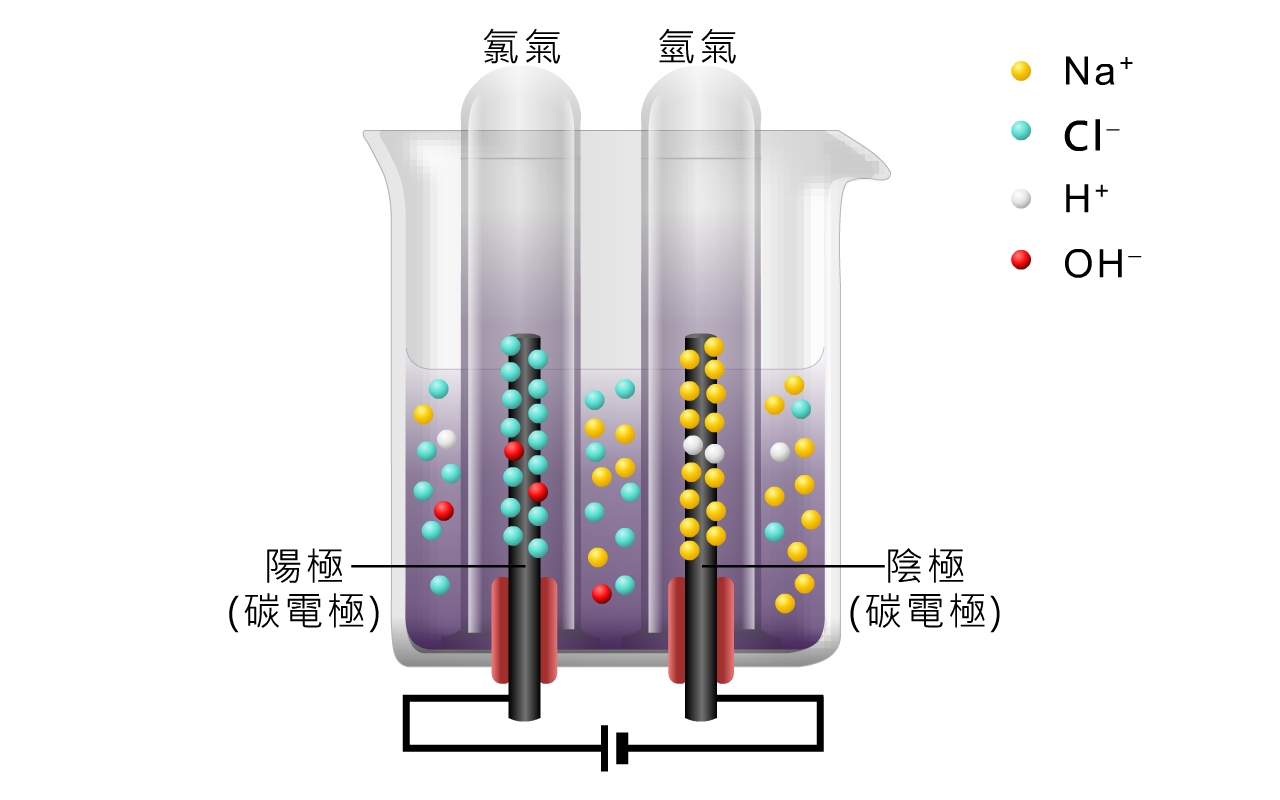
用石墨電極電解濃氯化鈉溶液時,發生的反應與電解極稀氯化鈉溶液的有所不同。
陽極反應:\(\ce{Cl^- (aq)} \) 優先放電,生成氯。
\[\ce{Cl^- (aq) -> Cl2(g) + 2e^-} \]陰極反應:\(\ce{H^+ (aq)} \) 優先放電,生成氫。
\[\ce{2H^+ (aq) + 2e^- -> H2(g)} \]溶液的變化:由於 \(\ce{H^+ (aq)} \) 和 \(\ce{Cl^- (aq)} \) 因放電而被消耗,\(\ce{Na^+ (aq)} \) 和 \(\ce{OH^- (aq)} \) 逐漸累積於溶液中,令溶液慢慢轉變為氫氧化鈉溶液。
在電解濃氯化鈉溶液時,為甚麼在陽極上放電的是 \(\ce{Cl^- (aq)} \) ,而不是 \(\ce{OH^- (aq)} \) 呢?