自然界中的固體大多數是晶體 (crystal)。晶體是構成物質的粒子 (如原子或離子等),按照一定的規則,排列成具有特定的幾何形狀的固體。例如,氯化鈉晶體呈立方體狀。形成晶體的過程,稱為結晶。結晶法適用於從溶液中分離出純淨的固體溶質。
由於固體物質的溶解度不同,因此,以結晶法獲取晶體可採用兩種不同的技巧——冷卻高濃度的熱溶液和讓溶液在室溫下緩慢地蒸發。

這種技巧多用於提取隨溫度的升高,溶解度顯著增大的固體溶質,例如硝酸鉀和硫酸銅(II)等。
操作方法:
原理:
同樣質量的熱溶劑比冷溶劑能容納更多的溶質,例如,\(100 \text{ g}\) \(60^{\circ} \text{C}\) 水最多能溶解 \(40.0 \text{ g}\) 硫酸銅(II),而 \(100 \text{ g}\) \(20^{\circ} \text{C}\) 水最多只能溶解 \(20.7 \text{ g}\) 硫酸銅(II)。因此,當高濃度的熱溶液冷卻後,溶劑不能繼續容納所有溶質,多餘的部分會從溶液中析出,形成晶體。
這種技巧多用於提取隨溫度的升高,溶解度隨略微增加卻變化不大的固體溶質,例如氯化鈉。
操作方法:
原理:
隨著溶劑慢慢蒸發,溶液的濃度會逐漸增加,直至達到飽和狀態。繼續靜置溶液,溶劑會持續因蒸發而減少。此時,剩餘的溶劑已不能再容納所有溶質,多餘的部分便會結成晶體,從溶液中析出。
與冷卻高濃度的熱溶液相比,讓溶液在室溫下緩慢地蒸發以獲取晶體的過程十分緩慢,但是,由於溶質粒子有足夠時間整齊地排列起來,因此,以這種技巧得到的晶體顆粒較大,形狀規則,且純度更高。


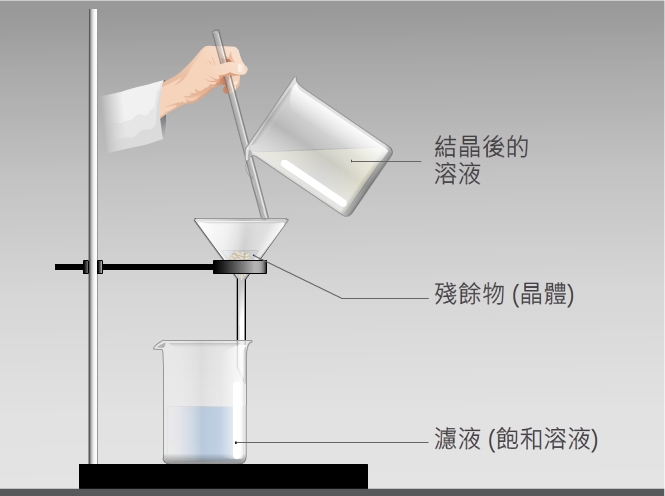
不論採用何種技巧,結晶法得到的晶體均是利用過濾法從溶液中分離出來的。只是在這種情況下,過濾所得到的殘餘物,才是我們需要的晶體,而濾液則是室溫下該溶質的飽和溶液。