化學家通常以生成物的百分產率來表達一個反應的效率。
\(\displaystyle \rm{百分產率}\ = \frac{\rm{實際產量}}{\rm{理論產量}} \times 100 \% \)
我們亦可從摩爾數計算百分產率。
\(\begin{align*} \rm{百分產率} &= \frac{\rm{實際摩爾數} \times \rm{分子量}}{\rm{理論摩爾數} \times \rm{分子量}} \times 100 \% \\ &= \frac{\rm{實際摩爾數}}{\rm{理論摩爾數}} \times 100 \% \end{align*}\)
一般而言,有機化合物的合成百分產率很少能夠達到 \(100\%\)。大部分有機化合物的反應的百分產率都不超過 \(70\%\),能夠超過 \(90\%\) 的已算是高效率的反應。
只要我們知道某生成物的理論摩爾數,便可計算出理論產量。那麼,我們要怎樣才能找到生成物的理論摩爾數呢?
不論是生成物的理論產量還是理論摩爾數,都是建基於一個假設:所有反應物都轉化為生成物。
在最簡單的情況下,
\(\rm{生成物的理論摩爾數} = \rm{反應物的摩爾數}\)
例如:假設所有反應物都轉化為生成物,在氯乙烷與氫氧化鈉溶液的取代反應中,\(1\;\rm{mol}\) 的 \(\ce{CH3CH2Cl}\) 生成 \(1\;\rm{mol}\) 的 \(\ce{CH3CH2OH}\)。

因此,當 \(5\;\rm{mol}\) 的 \(\ce{CH3CH2Cl}\) 與氫氧化鈉溶液產生取代反應時,\(\ce{CH3CH2Cl}\) 的理論摩爾數就是 \(5\;\rm{mol}\)。
但如果反應物(或限量試劑)和生成物的比例不是 \(1∶1\),那麼情況會稍為複雜。
例如:\(1\;\rm{mol}\) 的丁二烯與 \(2\;\rm{mol}\) 的溴產生加成反應,生成 \(1\;\rm{mol}\) 的 \(1,2,3,4-\)四溴丁烷。假設溴是限量試劑,那麼 \(2\;\rm{mol}\) 的溴生成 \(1\;\rm{mol}\) 的 \(1,2,3,4-\)四溴丁烷。
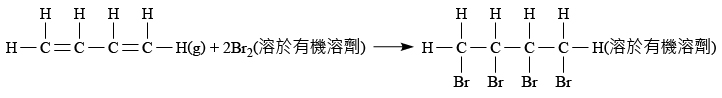
因此,當 \(10\;\rm{mol}\) 的溴與丁二烯產生加成反應時,\(1,2,3,4-\)四溴丁烷的理論摩爾數就是 \(5\;\rm{mol}\)。
\(\displaystyle \frac{\rm{反應物的摩爾數}}{\rm{反應物的反應系數}} = \frac{\rm{生成物的理論摩爾數}}{\rm{生成物的反應系數}} \)
\(46.0\;\rm{g}\) 的乙醇與氯化氫在回流加熱及氯化鋅的催化下,生成 \(51.6\;\rm{g}\) 的氯乙烷。計算氯乙烷的百分產率。
(提示:\(\displaystyle \rm{百分產率}\ = \frac{\rm{實際摩爾數}}{\rm{理論摩爾數}} \times 100 \% \) )
首先寫出化學反應式:
\[\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH + HCl }\xrightarrow{{}}\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl + }{{\text{H}}_{\text{2}}}\text{O}\]
假設 \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}\) 的理論產量為 \(\times \;\rm{g}\)
| \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH}\) | \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}\) | |
|---|---|---|
| 分子量 | \(46.0\;\rm{g}\;\rm{mol}^{-1}\) | \(64.5\;\rm{g}\;\rm{mol}^{-1}\) |
| 份量 | \(46.0\;\rm{g}\) | \(\text{x g}\) |
| 摩爾數 | \(\displaystyle \frac{46.0 \text{ g}}{46.0 \text{ g mol}^{-1}}\) | \(\displaystyle \frac{\text{x g}}{64.5 \text{ g mol}^{-1}}\) |
| 反應系數 | \(1\) | \(1\) |
然後計算反應物和生成物的分子量和摩爾數。
\[\begin{align*} \frac{反應物的摩爾數}{反應物的反應系數} &= \frac{生成物的理論摩爾數}{生成物的反應系數} \\ \\ \frac{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH}的摩爾數 {\kern 18pt}}{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH}的反應系數 {\kern 18pt}} &= \frac{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}的理論摩爾數 {\kern 18pt}}{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}的反應系數 {\kern 18pt}} \\ \\ \frac{\left(\frac{\text{46}\text{.0 g}}{\text{46}\text{.0 g mo}{{\text{l}}^{\text{-1}}}}\right)}{1} &= \frac{\left(\frac{\text{x g}}{\text{64}\text{.5 g mo}{{\text{l}}^{\text{-1}}}}\right)}{1} \\ \\ \text{x} &= 64.5 \end{align*}\]
\(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}\) 的理論產量為 \(64.5\;\rm{g}\)
\[\begin{align*} \text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}的百分產率 &= \frac{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}的實際產量 {\kern 18pt}}{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl}的理論產量 {\kern 18pt}}\times 100\text{%} \\ \\ &= \frac{\text{51}\text{.6 g}}{\text{64}\text{.5 g}}\times 100\text{%} \\ \\ &= 80.0 \% \end{align*}\]
因此,氯乙烷的百分產率是 \(80.0\%\)
\(46.0\;\rm{g}\) 乙醇與 \(45.0\;\rm{g}\) 三溴化磷回流加熱,生成 \(50.0\;\rm{g}\) 溴乙烷。計算溴乙烷的百分產率。
(提示:\(\displaystyle \rm{百分產率}\ = \frac{\rm{實際摩爾數}}{\rm{理論摩爾數}} \times 100 \% \))
首先寫出化學反應式:
\[\text{3C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH + PB}{{\text{r}}_{\text{3}}}\text{ }\xrightarrow{{}}\text{3C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br + }{{\text{H}}_{\text{3}}}\text{P}{{\text{O}}_{\text{3}}}\]
假設 \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\) 的理論產量為 \(\text{x g}\),然後計算反應物和生成物的分子量及摩爾數。
| \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH}\) | \(\text{PB}{{\text{r}}_{\text{3}}}\) | \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\) | |
|---|---|---|---|
| 分子量 | \(46.0\;\text{g mol}^{-1}\) | \(270.7\;\text{g mol}^{-1}\) | \(109.0\;\text{g mol}^{-1}\) |
| 份量 | \(46.0\;\rm{g}\) | \(45.0\;\rm{g}\) | \(\text{x g}\) |
| 摩爾數 | \(\displaystyle \frac{\text{46}\text{.0 g}}{\text{46}\text{.0 g mo}{{\text{l}}^{\text{-1}}}}\) | \(\displaystyle \frac{\text{45}\text{.0 g}}{\text{270}\text{.7 g mo}{{\text{l}}^{\text{-1}}}}\) | \(\displaystyle \frac{\text{x g}}{\text{109}\text{.0 g mo}{{\text{l}}^{\text{-1}}}}\) |
| 反應系數 | \(3\) | \(1\) | \(3\) |
根據反應式,\(3\;\rm{mol}\) 的 \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH}\) 與 \(1\;\rm{mol}\) 的 \(\text{PB}{{\text{r}}_{\text{3}}}\) 反應,生成 \(3\;\rm{mol}\) 的 \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\)。
因為 \(\displaystyle \frac{\left(\frac{\text{46}\text{.0 g}}{\text{46}\text{.0 g mo}{{\text{l}}^{\text{-1}}}}\right)}{3}\text{>}\frac{\left(\frac{\text{45}\text{.0 g}}{\text{270}\text{.7 g mo}{{\text{l}}^{\text{-1}}}}\right)}{1}\)
所以 \(\rm{PBr}_{3}\) 是限量試劑。
\[\begin{align*} \frac{反應物的摩爾數}{反應物的反應系數} &= \frac{生成物的理論摩爾數}{生成物的反應系數} \\ \\ \frac{\left(\frac{\text{45}\text{.0 g}}{\text{270}\text{.7 g mo}{{\text{l}}^{\text{-1}}}}\right)}{1} &= \frac{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br 的理論摩爾數} {\kern 18pt}}{\text{3} {\kern 18pt}} \\ \\ \text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br 的理論摩爾數} &= \text{0.499 mol} \end{align*}\]
\[\begin{align*} \text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\;的百分產率 &= \frac{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\;的實際摩爾數 {\kern 18pt}}{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\;的理論摩爾數 {\kern 18pt}}\times 100\text{%} \\ \\ &= \frac{\left( \frac{\text{50 g}}{\text{109}\text{.0 g mo}{{\text{l}}^{\text{-1}}}} \right)}{\text{0}\text{.499 mol}}\text{ }\!\!\times\!\!\text{100} \\ \\ &= 92.0 \% \end{align*}\]
因此,溴乙烷的百分產率是 \(92.0\%\)
在常溫常壓下,\(48.0\;\rm{dm}^{3}\) 的乙烯與 \(36.0\;\rm{dm}^{3}\) 的溴化氫產生加成反應,生成 \(150\;\rm{g}\) 溴乙烷。計算溴乙烷的百分產率。
(提示:在常溫常壓下,氣體的摩爾體積是 \(24.0\;\rm{dm}^{3}\)。)
首先寫出化學反應式:
\[{{\text{H}}_{\text{2}}}\text{C = C}{{\text{H}}_{\text{2}}}\text{ + HBr}\xrightarrow{{}}\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\]
假設 \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\) 的理論產量為 \(\text{x g}\),然後計算反應物和生成物的分子量及摩爾數。
| \({{\text{H}}_{\text{2}}}\text{C=C}{{\text{H}}_{\text{2}}}\) | \(\text{HBr}\) | \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\) | |
|---|---|---|---|
| 分子量 | \(28.0\text{ g mol}^{-1}\) | \(80.9\text{ g mol}^{-1}\) | \(109.0\text{ g mol}^{-1}\) |
| 份量 | \(48.0\text{ dm}^{3}\) | \(36.0\text{ dm}^{3}\) | \(\text{x g}\) |
| 摩爾數 | \(\displaystyle \frac{\text{48}\text{.0 d}{{\text{m}}^{\text{3}}}}{\text{24}\text{.0 d}{{\text{m}}^{\text{3}}}\text{ mo}{{\text{l}}^{\text{-1}}}}\) | \(\displaystyle \frac{\text{36}\text{.0 d}{{\text{m}}^{\text{3}}}}{\text{24}\text{.0 d}{{\text{m}}^{\text{3}}}\text{ mo}{{\text{l}}^{\text{-1}}}}\) | \(\displaystyle \frac{\text{x g}}{\text{109}\text{.0 g mo}{{\text{l}}^{\text{-1}}}}\) |
| 反應系數 | \(1\) | \(1\) | \(1\) |
根據反應式,\(1\;\rm{mol}\) 的 \({{\text{H}}_{\text{2}}}\text{C=C}{{\text{H}}_{\text{2}}}\) 與 \(1\;\rm{mol}\) 的 \(\text{HBr}\) 反應,生成 \(1\;\rm{mol}\) 的 \(\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\)。
因為 \(\displaystyle \frac{\left(\frac{\text{48}\text{.0 d}{{\text{m}}^{\text{3}}}}{\text{24}\text{.0 d}{{\text{m}}^{\text{3}}}\text{ mo}{{\text{l}}^{\text{-1}}}}\right)}{1}\text{<}\frac{\left(\frac{\text{36}\text{.0 d}{{\text{m}}^{\text{3}}}}{\text{24}\text{.0 d}{{\text{m}}^{\text{3}}}\text{ mo}{{\text{l}}^{\text{-1}}}}\right)}{1}\)
所以 \(\text{HBr}\) 是限量試劑。
\[\begin{align*} \frac{反應物的摩爾數}{反應物的反應系數} &= \frac{生成物的理論摩爾數}{生成物的反應系數} \\ \\ \frac{\left(\frac{\text{36}\text{.0 d}{{\text{m}}^{\text{3}}}}{\text{24}\text{.0 d}{{\text{m}}^{\text{3}}}\text{ mo}{{\text{l}}^{\text{-1}}}}\right)}{\text{1}} &= \frac{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br 的理論摩爾數} {\kern 18pt}}{\text{1} {\kern 18pt}} \\ \\ \text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br 的理論摩爾數} &= \text{1.50 mol} \end{align*}\]
\[\begin{align*} \text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\;的百分產率 &= \frac{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\;的實際摩爾數 {\kern 18pt}}{\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br}\;的理論摩爾數 {\kern 18pt}}\times 100\text{%} \\ \\ &= \frac{\left( \frac{\text{150 g}}{\text{109}\text{.0 g mo}{{\text{l}}^{\text{-1}}}} \right)}{\text{1}\text{.50 mol}}\text{ }\!\!\times\!\!\text{100} \\ \\ &= 91.7 \% \end{align*}\]
因此,溴乙烷的百分產率是 \(91.7\%\)