醇是飽和的碳化合物。它是由碳\(-\)氫鍵 \(\text{(C}-\text{H)}\)、碳\(-\)碳鍵 \(\text{(C}-\text{C)}\)、碳\(-\)氧鍵 \(\text{(C}-\text{O)}\)和氧\(-\)氫鍵 \(\text{(O}-\text{H)}\) 結構而成。
由於氧的電負性較碳高,因此碳\(-\)氧鍵是極性的:碳原子帶部分正電荷 (δ+),氧原子則帶部分負電荷 (δ−)。這導致碳\(-\)氧鍵中的碳原子比較缺電子,從而吸引帶負電荷的物種(例如鹵離子)及參與反應。
本節,我們就來學習醇與鹵化物的取代反應。
小知識:醇的官能基是羥基 \(\text{(}-\text{OH)}\),它的反應主要涉及 \(\text{C}-\text{O}\) 鍵或 \(\text{O}-\text{H}\) 鍵的斷裂,當中大部分反應只涉及 \(\text{C}-\text{O}\) 鍵的斷裂。
.jpg)
醇與鹵化氫 \(\left( \text{HCl、HBr 和 HI} \right)\text{ }\!\!~\!\!\text{ }\) 反應,生成鹵烷。這個反應涉及碳\(-\)氧鍵 \(\text{C}-\text{O}\) 的斷裂及碳\(-\)鹵鍵 \(\text{C}-\text{X}\) 的生成。
\[\text{R}-\text{OH(l) + HX(g)}\xrightarrow{{}}\text{R}-\text{X(l) + }{{\text{H}}_{\text{2}}}\text{O(l)}\]
例如:把乾的氯化氫通入無水的丁\(-1-\)醇中,並以少量無水的氯化鋅作為催化劑,便能生成 \(1-\)氯丁烷。
\[\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(l) + HCl(g)}\xrightarrow{\text{ZnC}{{\text{l}}_{\text{2}}}\text{催化劑}}\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl(l) + }{{\text{H}}_{\text{2}}}\text{O(l)}\]
不同的醇與鹵化氫進行取代反應,其反應速率亦有所不同。比較不同的醇與鹵化氫反應速率的分別,我們可得出以下的活性次序:
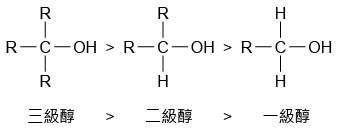
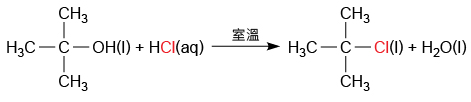
由於三級醇的活性較高,因此三級醇與濃氫氯酸的取代反應,即使在室溫下仍頗為迅速。例如:在溫室下,甲基丙\(-2-\)醇與濃氫氯酸迅速反應,生成甲基\(-2-\)氯丙烷。
一級醇的活性較低,因此一級醇與濃氫氯酸的取代反應須回流加熱,並以氯化鋅 \(\text{(ZnC}{{\text{l}}_{\text{2}}}\text{)}\) 作為催化劑。例如:丁\(-1-\)醇與濃氫氯酸須要回流加熱和加入氯化鋅催化劑,才可生成 \(1-\)氯丁烷。
\[\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(l) + HCl(aq)}\xrightarrow[\text{回流加熱}]{\text{ZnC}{{\text{l}}_{\text{2}}}\text{催化劑}}\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl(l) + }{{\text{H}}_{\text{2}}}\text{O(l)}\]
當反應物處於無水狀態,便能大大提高氯化鋅的催化效能。例如:在溫室下,把乾的氯化氫通入無水的丁\(-1-\)醇中,並以少量無水的氯化鋅作為催化劑,便能生成 \(1-\)氯丁烷。
\[\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(l) + HCl(g)}\xrightarrow{\text{ZnC}{{\text{l}}_{\text{2}}}\text{催化劑}}\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{Cl(l) + }{{\text{H}}_{\text{2}}}\text{O(l)}\]
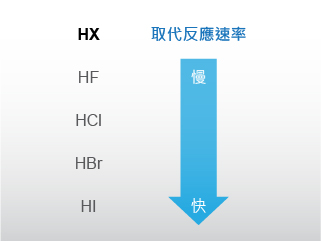
醇與鹵化氫產生取代反應的速率,會隨著鹵化氫的轉變而有所不同,其活性次序是
\[\text{HI }>\text{ HBr }>\text{ HCl }>\text{ HF}\]
碘化氫最為活潑,而氟化氫與醇的取代反應則非常緩慢。
那麼,你會怎樣製備溴烷和碘烷呢?
例如:我們可把丙\(-1-\)醇、濃硫酸和溴化鈉一起回流加熱,生成 \(1-\)溴丙烷。過程中,濃硫酸會與溴化鈉先反應,生成溴化氫。
\[{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\text{(l) + NaBr(s)}\xrightarrow{{}}\text{NaHS}{{\text{O}}_{\text{4}}}\text{(s) + HBr(g)}\]
剛生成的溴化氫繼而與丙\(-1-\)醇產生取代反應,生成 \(1-\)溴丙烷。
\[\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(l) + HBr(g)}\xrightarrow{{}}\text{C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br(l) + }{{\text{H}}_{\text{2}}}\text{O(l)}\]
醇與三鹵化磷進行取代反應,生成鹵烷。我們一般會把醇、紅磷和溴(或碘)組成的混合物在回流加熱。紅磷和溴(或碘)會在反應瓶內生成三鹵化磷,然後與醇反應。
例如:丁\(-1-\)醇可與三溴化磷 \(\text{(PB}{{\text{r}}_{\text{3}}}\text{)}\) 進行取代反應,生成 \(1-\)溴丁烷和亞磷酸 \(\text{(}{{\text{H}}_{\text{3}}}\text{P}{{\text{O}}_{\text{3}}}\text{)}\)。
\[\text{3C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH(l) + PB}{{\text{r}}_{\text{3}}}\text{(l)}\xrightarrow{回流加熱}\text{3C}{{\text{H}}_{\text{3}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{C}{{\text{H}}_{\text{2}}}\text{Br(l) + }{{\text{H}}_{\text{3}}}\text{P}{{\text{O}}_{\text{3}}}\text{(l)}\]
注意:三鹵化磷很容易與空氣中的水份產生反應,不易儲存,因此須即場製備。