簡單分子結構有兩個顯著的特點:
在簡單分子結構中,分子是穩定而獨立的最小單位;
分子的內部是由強大的共價鍵把原子互相連結;但在分子與分子之間,則是由微弱的分子間引力(又稱為范德華力)互相牽引。
「范德華力」是以在分子力方面做出傑出貢獻的荷蘭物理学家 Johannes van der Waals 的名字來命名的。我們會在其他章節詳細討論。
其中一個例子就是二氧化碳,碳原子和氧原子以強大的共價鍵構成二氧化碳分子,而二氧化碳分子之間則以范德華力互相牽引。
碘原子和碘原子以強大的共價鍵構成碘分子,但碘分子之間也是由微弱的范德華力互相牽引,因此它也是擁有簡單分子結構的物質。
巨型共價結構有兩個顯著的特點:
在巨型共價結構中,原子與原子之間是以強大的共價鍵互相連結;
眾多原子構成一個巨型的網狀結構,不斷向外伸延。
金剛石(即鑽石)和石英就是兩個擁有巨型共價結構的物質。
金剛石是由碳原子所組成,每個碳原子都與另外四個碳原子以共價鍵連結,構成四面體的形狀,並不斷伸延,形成一個巨型的網狀結構。
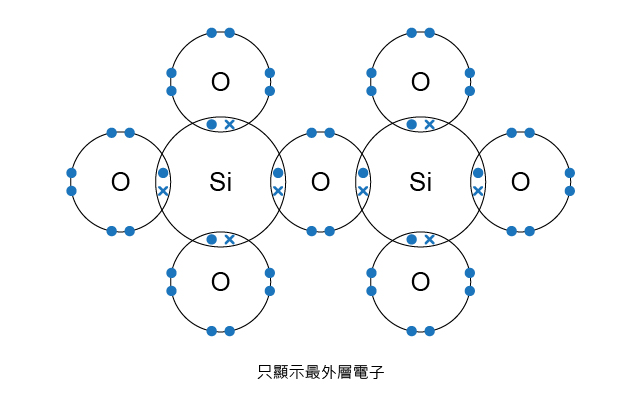
石英(即二氧化硅的結晶體)是一種礦物,在石英的結構中,每個硅原子與四個氧原子以強大的共價鍵連結,而每個氧原子又與兩個硅原子以強大的共價鍵連結 (因此硅原子與氧原子的簡單整數比為 \(1:2\)),形成一個巨型網狀結構。
具有簡單分子結構的物質通常都有某些普遍特性,例如:硬度低(如果該物質是固體)。
這是因為分子之間只由微弱的范德華力互相牽引,我們只需要施加少許外力就可以將分子間微弱的范德華力破壞。
固態的二氧化碳(即是「乾冰」)具有簡單分子結構,我們只需施加少許外力就可以把它壓碎。
在常溫常壓下,碘是固體,但它也具有簡單分子結構,我們只需施加少許外力就可以把它壓碎。
具有巨型共價結構的物質通常都有某些普遍特性,例如:硬度高(如果該物質是固體)。
巨型共價結構的物質內,每個原子都是由強大的共價鍵互相連結,並且形成網狀結構,所以這些物質非常堅硬。
例如金剛石是在眾多已知的物質中最堅硬的物質,常用於切割玻璃,或雕刻物件。
而石英也是非常堅硬的固體。
具有簡單分子結構的物質通常都有某些普遍特性,例如:熔點和沸點一般都很低。
| 簡單分子 | 熔點 (\(^\circ \text{C}\)) | 沸點 (\(^\circ \text{C}\)) |
|---|---|---|
| 二氧化碳 | \(−78\) | \(−57\) |
| 碘 | \(113\) | \(184\) |
這是因為分子之間只由微弱的范德華力互相牽引,我們只需要施加少許熱能就可以將分子間微弱的范德華力破壞。
具有巨型共價結構的物質通常都有某些普遍特性,例如:熔點一般都很高。
| 巨型共價結構的物質 | 熔點 (\(^\circ \text{C}\)) |
|---|---|
| 石英 | \(1610\) |
| 金剛石 | \(3500\) |
這是因為在具有巨型共價結構的物質之中,所有原子都是由強大的共價鍵互相連結。所以在熔化巨型共價結構物質時,需要使用大量熱能破壞原子之間強大的共價鍵。
具有簡單分子結構的物質通常都有某些普遍特性,例如:水溶性低,但易溶於非水溶劑(如醚、甲苯或庚烷等)。
因為大多數具有簡單分子結構的物質都是非極性的分子(例如:二氧化碳、碘分子……等等),而水分子則是極性分子。
極性分子之間的吸力頗強,
非極性分子和極性分子之間的吸引力則較弱,
因此非極性分子很難混入極性分子之間。這解釋了為何簡單分子結構的物質的水溶性較低。而非水溶劑之間的吸引力較弱,非極性分子較易混入,因此簡單分子結構的物質較易溶於非水溶劑。
但有部分簡單分子結構的物質,是極性分子,例如氯化氫和水。
這些極性分子則比較溶於極性溶劑,而不溶於非極性溶劑。
具有簡單分子結構的物質通常都有某些普遍特性,例如:不能導電。這是因為簡單分子結構中沒有可以自由流動的離子或電子。
請注意:某些具有簡單分子結構的物質溶於水後可以導電,例如氨、氯化氫、二氧化硫等等,但是導電的粒子並不是這些物質的分子,而是它們的分子與水反應或在水中電離後產生的可以流動的離子。因此不可把二者混為一談。
具有巨型共價結構的物質通常都有某些普遍特性,例如:不能導電。這是因為在巨型共價結構物質的原子既沒有自由電子,也沒有帶電荷的離子。
就以二氧化硅為例,硅原子的全部最外層電子都形成共價鍵;氧原子的最外層電子要麼形成共價鍵,要麼是孤電子對留在氧原子中,因此二氧化硅沒有自由電子,所以不能導電。
但亦有例外,石墨是由碳原子組成並且擁有巨型共價結構的物質,但它是有良好的導電性。
碳原子有 \(4\) 個最外層電子,但在石墨中,每個碳原子都只與另外 \(3\) 個碳原子生成共價鍵,因此每個碳原子都有 \(1\) 個沒有生成鍵的最外層電子。
